
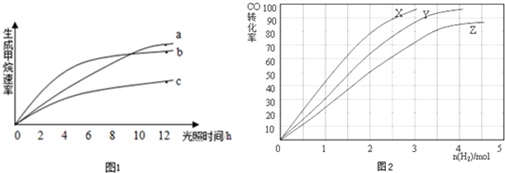
���� ��1����ѧ��Ӧ����Խ��ģ������ʱ���ڵõ��ļ�������ࣻ
����v=$\frac{��c}{��t}$����v��CO��������������֮�ȵ��ڻ�ѧ������֮�ȼ���v��H2����
A�����������¶ȣ�ƽ�������ƶ���
B�����º�ѹ�³��뺤���������ݻ�����ƽ�������ƶ���
C����������С���������ѹǿ����ƽ�������ƶ���
D�����º������ٳ�������ʵ�����CH4��H2O����ЧΪ��ԭƽ��Ļ���������һ��ѹǿ����ԭƽ����ȣ�ƽ�������ƶ���
��3������֪����CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.5kJ•mol-1
��CO2��g��+H2��g��?CO��g��+H2O��g����H=+41.3kJ•mol-1
���ݸ�˹���ɣ���-��ɵã�CO��g��+2H2��g��?CH3OH��g�����ݴ˼��㣻
������ӦΪ�������ʵ�����С�ķ�Ӧ�����S��0���ٸ��ݡ�G=��H-T��S��0ʱ��Ӧ�Է����з�����
��4���ϳɼ״��Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���CO��ת���ʼ�С����230��ʱ��ʵ��������Ӧ��������X��270���Ӧ��������Z����������Ϊ2molʱ��COת����Ϊ50%������ƽ��ʱ����ֵ����ʵ��������������Ϊ1L������ƽ�ⳣ��K���㣮
��� �⣺��1������ͼʾ���������ߣ�b��б��������Է�Ӧ������죬��ʼ���12Сʱ�ڣ��ռ����ļ�����ࣻ
�ʴ�Ϊ��b��
��2��5min��CO��ƽ����ѧ��Ӧ����v��CO��=$\frac{0.1mol��2L}{5min}$=0.01mol/��L•min��������֮�ȵ��ڻ�ѧ������֮�ȣ�v��H2��=3v��CO��=0.03mol/��L•min����
A�����������¶ȣ���ѧƽ�������ƶ���n��CO������n��CH4����С��n��CO����n��CH4������A��ȷ��
B�����º�ѹ�³��뺤���������ݻ�����ƽ�������ƶ���n��CO������n��CH4����С��n��CO����n��CH4��������B��ȷ��
C����������С���������ѹǿ����ƽ�������ƶ���n��CO����С��n��CH4������n��CO����n��CH4����С����C����
D�����º������ٳ�������ʵ�����CH4��H2O����ЧΪ��ԭƽ��Ļ���������һ��ѹǿ����ԭƽ����ȣ�ƽ�������ƶ���n��CO����n��CH4����С����D����
�ʴ�Ϊ��0.03mol/��L•min����AB��
��3������֪����CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.5kJ•mol-1
��CO2��g��+H2��g��?CO��g��+H2O��g����H=+41.3kJ•mol-1
���ݸ�˹���ɣ���-��ɵã�CO��g��+2H2��g��?CH3OH��g����H=-90.8kJ•mol-1��
�ʴ�Ϊ��CO��g��+2H2��g��?CH3OH��l����H=-90.8kJ•mol-1��
������ӦΪ�������ʵ�����С�ķ�Ӧ�����S��0������ӦΪ���ȷ�Ӧ�����H��0���¶Ƚϵ�ʱ����G=��H-T��S��0��Ӧ�Է����У����Ե��������ڷ�Ӧ�Է����У�
�ʴ�Ϊ���������£�
��4���÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���CO��ת���ʼ�С����230��ʱ��ʵ��������Ӧ��������X��270���Ӧ��������Z����������Ϊ2molʱ��COת����Ϊ50%����
CO��g��+2H2��g��?CH3OH��g��
��ʼ����mol����1 2 0
�仯����mol����0.5 1 0.5
ƽ������mol����0.5 1 0.5
���������Ϊ1L����ѧƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{c��CO��•{c}^{2}��{H}_{2}��}$=$\frac{0.5}{0.5��{1}^{2}}$=1��
�ʴ�Ϊ��X���÷�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ��ת����Խ�ߣ�K=$\frac{c��C{H}_{3}OH��}{c��CO��•{c}^{2}��{H}_{2}��}$=$\frac{0.5}{0.5��{1}^{2}}$=1��
���� ���⿼���˻�ѧƽ����йؼ��㡢Ӱ�컯ѧƽ������ء���˹�����Լ���Ӧ�Է����е��жϣ���Ŀ�Ѷ��еȣ�Ҫ��ѧ���Ի���֪ʶ������ʵ��Ӧ�õ�������Ŀ���


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� | 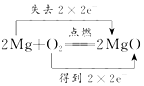 | ||
| C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ȼ��������ȼ������ǰ�������������Ĵ��� | |
| B�� | ���촵��ƾ��ƻ��� | |
| C�� | �����Թ����Һ��ʱ���Թܿڶ������� | |
| D�� | ��ˮע��Ũ�����н���ϡ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
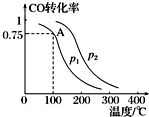 ����CO��H2���Ժϳɼ״�����Ӧԭ��ΪCO��g��+2H2��g���TCH3OH��g����һ�������£����ݻ�ΪV L���ܱ������г���a mol CO��2a mol H2�ϳɼ״���ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
����CO��H2���Ժϳɼ״�����Ӧԭ��ΪCO��g��+2H2��g���TCH3OH��g����һ�������£����ݻ�ΪV L���ܱ������г���a mol CO��2a mol H2�ϳɼ״���ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
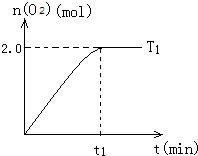 һ���¶��£���2L�ܱ������м�������Cu2O��ͨ��10.0molˮ������������Ӧ��2H2O��g��?2H2��g��+O2��g����H=+484kJ/mol��T1�¶��²�ͬʱ�β���O2������������
һ���¶��£���2L�ܱ������м�������Cu2O��ͨ��10.0molˮ������������Ӧ��2H2O��g��?2H2��g��+O2��g����H=+484kJ/mol��T1�¶��²�ͬʱ�β���O2������������| ʱ��/min | 20 | 40 | 60 | 80 |
| n��O2��/mol | 1.0 | 1.6 | 2.0 | 2.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
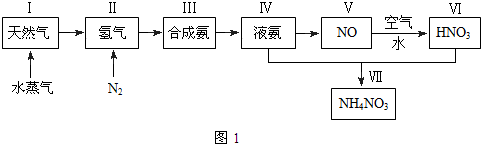
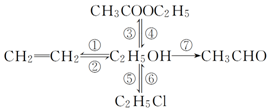 д�����и������ת���Ļ�ѧ����ʽ����˵�������ķ�Ӧ���ͣ�
д�����и������ת���Ļ�ѧ����ʽ����˵�������ķ�Ӧ���ͣ��鿴�𰸺ͽ���>>
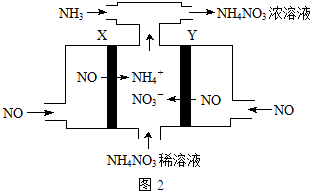
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
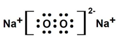
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com