
| N2 | O2 | Ar | CO2 |
| -196°C | -183°C | -186°C | -78°C |
| ||
| ||


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源:不详 题型:单选题
| A.蒸发操作时,不能使混合物中的水分完全蒸干后,才停止加热 |
| B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用酒精萃取碘水中的碘 |
| B.在容量瓶中溶解氢氧化钠固体 |
| C.用加热的方法分离氯化钠和氯化铵固体 |
| D.用溶解、过滤的方法除去粗盐中的氯化钙和氯化镁等杂质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 物质 | 试剂 | 物质 | 试剂 |
| CuO(Al2O3) | ______ | Si02(CaO) | ______ |
| NaHCO3溶液(Na2CO3) | ______ | Fe(Al) | ______ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑦ | B.①④⑧ | C.②⑥⑦ | D.④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | 选用试剂(过量) | 操作方法 | |
| A | Cu(CuO) | 氧气 | 通入氧气并加热 |
| B | CO2(HCl) | 饱和碳酸氢钠溶液 | 通过盛有饱和NaHCO3溶液的洗气瓶 |
| C | CO(H2) | 氧化铜 | 通过灼热的氧化铜 |
| D | KCl溶液(K2CO3) | 氯化钙溶液 | 加入氯化钙溶液充分反应后过滤 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.蒸发 | B.分液 | C.过滤 | D.蒸馏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
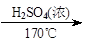 CH2=CH2+H2O
CH2=CH2+H2O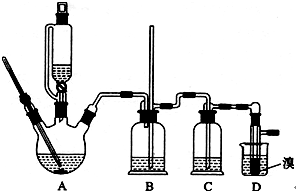
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/oC | 78.5 | 132 | 34.6 |
| 熔点/oC | -130 | 9 | -116 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com