
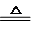 MnCl2+Cl2”ü+H2O£®×°ÖĆBÖŠŹ¢·ÅµÄŹŌ¼ĮĪŖ±„ŗĶŹ³ŃĪĖ®£¬Ęä×÷ÓĆĪŖ³żČ„ĀČĘųÖŠµÄĀČ»ÆĒāĘųĢ壮
MnCl2+Cl2”ü+H2O£®×°ÖĆBÖŠŹ¢·ÅµÄŹŌ¼ĮĪŖ±„ŗĶŹ³ŃĪĖ®£¬Ęä×÷ÓĆĪŖ³żČ„ĀČĘųÖŠµÄĀČ»ÆĒāĘųĢ壮 £®
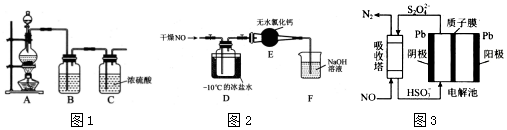
£®·ÖĪö £Ø1£©ŹµŃéŹŅĀČĘųÖʱøŹĒĄūÓĆÅØŃĪĖįŗĶMnO2»ģŗĻ¼ÓČČ£¬½įŗĻµē×ÓŹŲŗć”¢Ō×ÓŹŲŗ抓³ö“Ė·“Ó¦µÄ»Æѧ·½³ĢŹ½£»ÅØŃĪĖįÓŠ»Ó·¢ŠŌ£¬ÖʵƵÄĀČĘųÖŠ»ģÓŠHCl£¬Ó¦ĶعżBÖŠČÜŅŗ³żŌÓ£¬¾Ż“Ė·ÖĪöÅŠ¶Ļ£»
£Ø2£©¢ŁNOCl·Ö×ÓÖŠø÷Ō×Ó¾łĀś×ć8µē×ÓĪČ¶Ø½į¹¹£¬ŌņµŖŌ×ÓÓėŃõŌ×ÓŠĪ³ÉĮ½¶Ō¹²ÓƵē×Ó¶Ō£¬ÓėĀČŌ×ÓŠĪ³ÉŅ»¶Ō£»
¢Ś×°ÖĆDÖŠÓÉ»ĘĀĢÉ«µÄĀČĘųÉś³ÉĮĖŗģŗÖÉ«ŅŗĢåNOCl£¬øł¾Ż·“Ó¦ĪļÖ®¼ä·¢ÉśµÄŃõ»Æ»¹Ō·“Ó¦£¬½įŗĻµē×ÓŹŲŗćŹéŠ“»Æѧ·½³ĢŹ½£»
¢Ūøł¾ŻNOClÓöĖ®Ņ×·Ö½ā£¬¹Ź×°ÖĆÖŠÓ¦ĪŽĖ®·ÖĪö£»
¢ÜNO²»ČÜÓŚĖ®£¬æÉÓėŃõĘųŅ»Ķ¬ĶØČėĒāŃõ»ÆÄĘĪüŹÕ£»
£Ø3£©¢ŁĮņ“śĮņĖįøłĄė×ÓÓėŅ»Ńõ»ÆµŖ·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬Éś³ÉµŖĘų£¬æÉøł¾ŻĄė×Ó·“Ó¦·½³ĢŹ½»ņµē×ÓŹŲŗćÅŠ¶ĻŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±Č£»
¢ŚŅõ¼«·¢Éś»¹Ō·“Ó¦£¬ŹĒŃĒĮņĖįĒāøłĄė×Ó£¬µĆµē×Ó£¬Éś³ÉĮņ“śĮņĖįøłĄė×Ó£®
½ā“š ½ā£Ø1£©ŹµŃéŹŅĄūÓƶžŃõ»ÆĆĢŗĶÅØŃĪĖį»ģŗĻ¼ÓČČÖĘCl2£¬·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖMnO2+4HCl 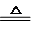 MnCl2+Cl2”ü+2H2O£»æÉŃ”ÓƶžŃõ»ÆĆĢŗĶÅØŃĪĖį£¬ÖʵƵÄĀČĘųÖŠÓŠĀČ»ÆĒāĘųĢ壬ÓƱ„ŗĶŹ³ŃĪĖ®³żČ„£»
MnCl2+Cl2”ü+2H2O£»æÉŃ”ÓƶžŃõ»ÆĆĢŗĶÅØŃĪĖį£¬ÖʵƵÄĀČĘųÖŠÓŠĀČ»ÆĒāĘųĢ壬ÓƱ„ŗĶŹ³ŃĪĖ®³żČ„£»
¹Ź“š°øĪŖ£ŗMnO2+4HCl 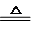 MnCl2+Cl2”ü+H2O£»±„ŗĶŹ³ŃĪĖ®£»³żČ„ĀČĘųÖŠµÄĀČ»ÆĒāĘųĢ壻
MnCl2+Cl2”ü+H2O£»±„ŗĶŹ³ŃĪĖ®£»³żČ„ĀČĘųÖŠµÄĀČ»ÆĒāĘųĢ壻
£Ø2£©¢ŁNOCl·Ö×ÓÖŠø÷Ō×Ó¾łĀś×ć8µē×ÓĪČ¶Ø½į¹¹£¬ŌņµŖŌ×ÓÓėŃõŌ×ÓŠĪ³ÉĮ½¶Ō¹²ÓƵē×Ó¶Ō£¬ÓėĀČŌ×ÓŠĪ³ÉŅ»¶Ō£¬µē×ÓŹ½ĪŖ£ŗ £»
£»
¹Ź“š°øĪŖ£ŗ £»
£»
¢Ś×°ÖĆDÖŠĪŖĀČĘųÖʱøNOCl£¬ĪŖ»ĘĀĢÉ«ĘųĢåÖš½„±äĒ³£¬ÓŠŗģŗÖÉ«ŅŗĢåÉś³É£¬·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ2NO+Cl2=2NOCl£»
¹Ź“š°øĪŖ£ŗ2NO+Cl2=2NOCl£»
¢ŪNOClÓöĖ®Ņ×·Ö½ā£¬Čē¹ūƻӊװÖĆEÖŠĪŽĖ®ĀČ»ÆøĘĪüŹÕĖ®ÕōĘų£¬FÖŠµÄĖ®ÕōĘų½ųČė D ×°ÖĆÖŠ£¬»įµ¼ÖĀ²śĘ·Ė®½ā£»
¹Ź“š°øĪŖ£ŗFÖŠµÄĖ®ÕōĘų½ųČė D ×°ÖĆÖŠ£¬»įµ¼ÖĀ²śĘ·Ė®½ā£»
¢ÜNO²»ČÜÓŚĖ®£¬æÉÓėŃõĘųŅ»Ķ¬ĶØČėĒāŃõ»ÆÄĘĪüŹÕ£¬”¢£»
¹Ź“š°øĪŖ£ŗNO£»O2£»
£Ø3£©¢ŁĮņ“śĮņĖįøłĄė×ÓÓėŅ»Ńõ»ÆµŖ·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬Éś³ÉµŖĘų£¬Ąė×Ó·“Ó¦·½³ĢŹ½ĪŖ£ŗ2NO+2S2O42-+2H2OØTN2+4HSO3-£¬ĘäÖŠNOĪŖŃõ»Æ¼Į£¬ĪŖ»¹Ō¼Į£¬Į½ÕßµÄĪļÖŹµÄĮæÖ®±ČĪŖ1£ŗ1£¬¹Ź“š°øĪŖ£ŗ1£ŗ1£»
¢ŚŅõ¼«·¢Éś»¹Ō·“Ó¦£¬ŹĒŃĒĮņĖįĒāøłĄė×Ó£¬µĆµē×Ó£¬Éś³ÉĮņ“śĮņĖįøłĄė×Ó£¬µē¼«·“Ó¦Ź½ĪŖ£ŗ2HSO3-+2e-+2H+ØTS2O42-+2H2O£»
¹Ź“š°øĪŖ£ŗ2HSO3-+2e-+2H+ØTS2O42-+2H2O£®
µćĘĄ ±¾Ģāæ¼²éĮĖĪļÖŹÖʱø·½°øÉč¼Ę£¬Ö÷ŅŖæ¼²éĮĖ»Æѧ·½³ĢŹ½µÄŹéŠ“”¢ŹµŃé·½°øĘĄ¼Ū”¢Ńõ»Æ»¹Ō·“Ó¦”¢»·¾³±£»¤µČ£¬ĢāÄæÄѶČÖŠµČ£¬²ąÖŲÓŚæ¼²éѧɜµÄ·ÖĪöĪŹĢāŗĶ½ā¾öĪŹĢāµÄÄÜĮ棬עŅāĻą¹Ų»ł“”ÖŖŹ¶µÄѧĻ°Óė»żĄŪ£®


 Č«Óųå“Ģ100·ÖĻµĮŠ“š°ø
Č«Óųå“Ģ100·ÖĻµĮŠ“š°ø Ó¢²Åµć½ņĻµĮŠ“š°ø
Ó¢²Åµć½ņĻµĮŠ“š°ø ŗģ¹ū×ÓČż¼¶²āŹŌ¾ķĻµĮŠ“š°ø
ŗģ¹ū×ÓČż¼¶²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ³£ĪĀĻĀ£¬5.6g½šŹōĢśĶ¶Čė×ćĮæµÄÅØĮņĖįÖŠ£¬µē×Ó×ŖŅĘŹżĪŖ0.3NA | |
| B£® | 18g D2OĖłŗ¬µÄÖŠ×ÓŹżĪŖ10NA | |
| C£® | ±ź×¼×“æöĻĀ£¬8 gSO3Ėłŗ¬Ō×ÓŹżĪŖ0.4NA | |
| D£® | ³£ĪĀĻĀ£¬1.0LpH=13µÄBa £ØOH£© 2ČÜŅŗÖŠŗ¬ÓŠµÄOH-ŹżÄæĪŖ0.2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
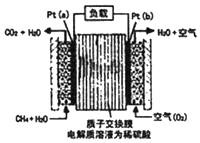 ijÖÖ¼×ĶéČ¼ĮĻµē³Ų²ÉÓĆ²¬×÷µē¼«£¬µē³ŲÖŠµÄÖŹ×Ó½»»»Ä¤Ö»ŌŹŠķÖŹ×ÓŗĶĖ®·Ö×ÓĶعż£¬Ę仳±¾½į¹¹ČēĶ¼£¬µē³Ų×Ü·“Ó¦ĪŖ£ŗCH4+2O2ØTCO2+2H2O£®ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ijÖÖ¼×ĶéČ¼ĮĻµē³Ų²ÉÓĆ²¬×÷µē¼«£¬µē³ŲÖŠµÄÖŹ×Ó½»»»Ä¤Ö»ŌŹŠķÖŹ×ÓŗĶĖ®·Ö×ÓĶعż£¬Ę仳±¾½į¹¹ČēĶ¼£¬µē³Ų×Ü·“Ó¦ĪŖ£ŗCH4+2O2ØTCO2+2H2O£®ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | µē×ÓÓÉa¼«Į÷³ö¾¹żøŗŌŲĮ÷Ļņb¼« | |
| B£® | µē½āÖŹČÜŅŗÖŠH+ŅĘĻņa¼« | |
| C£® | Ćæ×ŖŅĘ1mole-£¬ĻūŗÄ1.6gCH4 | |
| D£® | b¼«ÉĻµÄµē¼«·“Ó¦Ź½ĪŖ£ŗO2+2H2O+4e-=4OH- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 8ÖÖ | B£® | 10ÖÖ | C£® | 11ÖÖ | D£® | 12ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.1mol-NH2£Ø°±»ł£©ÖŠĖłŗ¬ÓŠµÄµē×ÓŹżĪŖ0.9NA | |
| B£® | lmol D218OĖłŗ¬µÄÖŠ×ÓŹżĪŖ12NA | |
| C£® | 14 g¾ŪŅŅĻ©Óė¾Ū±ūĻ©µÄ»ģŗĻĪļÖŠŗ¬HŌ×ӵďżÄæĪŖ2NA | |
| D£® | Ņ»¶ØĢõ¼žĻĀ£¬0.2 mol SO2Óė×ćĮæO2³ä·Ö·“Ó¦£¬Éś³ÉµÄSO3·Ö×ÓŹżĪŖ0.2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | °±Ė®ŗĶŃĪĖį | B£® | ĒāŃõ»ÆÄĘČÜŅŗŗĶ“×Ėį | ||
| C£® | ĮņĖįŗĶĒāŃõ»Æ±µČÜŅŗ | D£® | ĻõĖįŗĶŹÆ»ŅĖ® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 3ÖÖČÜŅŗÖŠpH×īŠ”µÄŹĒ¢Ł | |
| B£® | 3ÖÖČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č×ī“óµÄŹĒ¢Ś | |
| C£® | ¢ŁÓė¢ŚµČĢå»ż»ģŗĻŗóČÜŅŗĻŌĖįŠŌ | |
| D£® | ¢ŁÓė¢ŪµČĢå»ż»ģŗĻŗóc£ØH+£©£¾c£ØCH3COO-£©£¾c£ØOH-£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com