
通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能.键能的大小可以估量化学键的强弱,也可以估计化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下列是一些化学键的键能.根据键能数据估算下列反应的反应热,CH4(g)+4F2(g)=CF4(g)+4HF(g)的△H为()
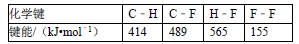
A.﹣1940 kJ/mol
B.+1940 kJ/mol
C.﹣485 kJ/mol
D.+485 kJ/mol
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源:2017届内蒙古高三上第二次月考化学试卷(解析版) 题型:选择题
在恒容密闭容器中通入X并发生反应:2X(g) 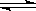 Y(g),在温度T1、T2下,Y的物质的量浓度c(Y)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),在温度T1、T2下,Y的物质的量浓度c(Y)随时间t变化的曲线如图所示,下列叙述正确的是

A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.N点的逆反应速率v逆大于W点的逆反应速率v逆
C.T1 > T2
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上10月月考化学试卷(解析版) 题型:选择题
表面介导电池(SMCS)是一种新型充电电池,该电池的电极材料为金属锂和氧化石墨烯.下列有关说法中不正确的是( )
A.放电时,氧化石墨烯作正极
B.放电时,负极电极反应式为Li﹣e-═Li+
C.充电时,该电池是将电能转化为化学能
D.放电时,电解质溶液中的Li+从正极迁移到负极
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
已知:可逆反应N2(g)+3H2(g)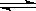 2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1molN2(g)和3molH2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2molNH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是
2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1molN2(g)和3molH2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2molNH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是
A.达平衡时甲中NH3的体积分数为75%
B.达平衡时甲、乙中NH3的体积分数乙>甲
C.达到平衡后,再向乙中加入0.25molN2(g)、0.75molH2(g)和1.5molNH3(g),平衡向生成NH3的方向移动
D.乙中反应的热化学方程式为2NH3(g)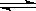 N2(g)+3H2(g);△H=+Q2kJ/mol
N2(g)+3H2(g);△H=+Q2kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
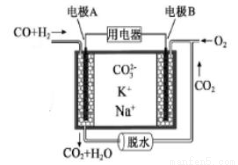
A.电极A上发生的是还原反应
B.电池工作时,CO32-向电极B移动
C.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
D.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:实验题
现进行实验,测定草酸晶体(H2C2O4·xH2O)中的x值;
(1)称取Wg草酸晶体,配成100.00mL溶液
(2)取25.00mL所配溶液于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
①本实验中,必需要用的仪器有(从下列仪器中选择,填序号)__________________,还缺少的仪器有(填名称):_______________________。
A、托盘天平(带砝码、镊子)
B、滴定管
C、100mL的量筒
D、100mL的容量瓶
E、烧杯
F、漏斗
G、锥形瓶
H、玻璃棒
I、药匙
J、烧瓶
②标准液KMnO4溶液应装在__________式滴定管中。
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的x的值会__________(填偏大、偏小、无影响)。
④在滴定过程中若用去amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为_________mol·L-1,由此,x=__________。
⑤若滴定终点读数时仰视刻度,则计算的x值会__________(填偏大、偏小、无影响)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
下列各组离子中.在溶液里能大量共存,且溶液为无色透明的是
A.NH4+、NO3-、Al3+CL-
B.Na+、SiO32-、NO3-、Fe3+
C.Na+、MnO4-、K+、SO42-
D.Na+、HCO3-、SO42-、Al3+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:填空题
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L 0.l mol/L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中
[c(CH3COO-)·c(H+)]/c(CH3COOH) (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4-9之间。土壤中Na2CO3含量较高,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ,加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为
(3)常温下在20ml 0.1mo l·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如图所示。

回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为 ,溶液中各种离子的物质的量浓度的大小关系
为 ;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol·L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH= ;
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
下列叙述正确的是
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7
C.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com