
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 从左向右数第六纵行是ⅥA族 | |
| B. | 所含元素形成的化合物种类最多的族是第IVA族 | |
| C. | 七个周期18个族 | |
| D. | ⅠA族全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键存在所有单质和化合物中 | |
| B. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| C. | 只要有能量变化,则一定发生了化学反应 | |
| D. | 当反应物的总能量低于生成物的总能量时,该反应放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 | |
| B. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| C. | 第二周期元素从左到右第一电离能依次增大 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
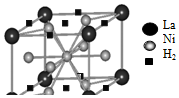 能源、材料和信息是现代社会的三大“支柱”.
能源、材料和信息是现代社会的三大“支柱”. .d.HCHO,其中碳原子采取sp2杂化的分子有a、c、d(填字母).
.d.HCHO,其中碳原子采取sp2杂化的分子有a、c、d(填字母).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③ | C. | ①② | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com