
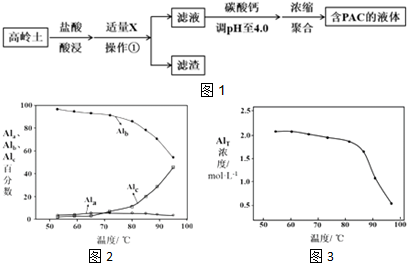
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |
分析 高岭土的主要化学组成为Al2O3、SiO2、Fe2O3,由制备流程可知,加盐酸发生6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O,加X可调节pH使铁离子转化为沉淀,则过滤后的滤渣为SiO2、Fe(OH)3,滤液中含铝离子,用碳酸钙调节溶液的pH时,要严控pH的大小,pH偏小或偏大液体PAC的产率都会降低,最后浓缩、聚合得到聚合氯化铝(PAC),并结合习题中的信息及图象来解答.
解答 解:高岭土的主要化学组成为Al2O3、SiO2、Fe2O3,由制备流程可知,加盐酸发生6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O,加X可调节pH使铁离子转化为沉淀,则过滤后的滤渣为SiO2、Fe(OH)3,滤液中含铝离子,用碳酸钙调节溶液的pH时,要严控pH的大小,pH偏小或偏大液体PAC的产率都会降低,最后浓缩、聚合得到聚合氯化铝(PAC),
(1)盐酸酸浸所涉及反应的离子方程式是6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O,
故答案为:6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O;
(2)由表中数据可知加入X的主要目的调节溶液pH至Fe3+完全沉淀,由上述分析可知,滤渣中主要含有物质的化学式是Fe(OH)3、SiO2,
故答案为:调节溶液pH至Fe3+完全沉淀;Fe(OH)3、SiO2;
(3)用碳酸钙调节溶液的pH时,要严控pH的大小,pH偏小或偏大液体PAC的产率都会降低,解释pH偏小液体PAC产率降低的原因为pH偏小时,抑制平衡2Al3++m(6-n) Cl-+mn H2O?[Al2(OH)nCl6-n]m+mn H+ 正向移动生成PAC,
故答案为:pH偏小时,抑制平衡2Al3++m(6-n) Cl-+mn H2O?[Al2(OH)nCl6-n]m+mn H+ 正向移动生成PAC;
(4)①由图2可知,50-90℃之间制备的液体PAC中,聚合形态铝含量最多,故答案为:聚合;
②当T>80℃时,AlT明显降低的原因是温度升高,导致液体PAC向Al(OH)3沉淀转化,故答案为:温度升高,导致液体PAC向Al(OH)3沉淀转化.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程及习题中的表格、图象等为解答的关键,侧重分析与应用、实验能力的综合考查,题目难度中等.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C4H8 | D. | C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g CH4所含共价键数目为2NA | |
| B. | 0.5NA 个氯气分子与水反应转移电子数为0.5NA | |
| C. | 50mL12mol/L盐酸与足量的MnO2共热,转移的电子数为0.3NA | |
| D. | 1 L0.2mol/L的Na2S溶液中离子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度mol•L-1 | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol•L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | - | - | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1-100nm之间 | |
| B. | 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体 | |
| D. | 下图图片显示的是树林中的晨曦,该现象与丁达尔现象有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cu2+、Cl-、NO3- | B. | Fe2+、Na+、NO3-、Cl- | ||
| C. | K+、Na+、CO32-、SO42- | D. | K+、Na+、SO42-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加盐酸时,先产生沉淀又溶解 | |
| B. | 都能透过半透膜 | |
| C. | 加热、蒸干、灼烧,最终都有Fe2O3生成 | |
| D. | 都有丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com