
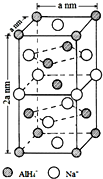
分析 AlH4-中,Al的轨道杂化数目为4+$\frac{3+1-1×4}{2}$=4,Al采取sp3杂化,为正四面体构型,据此可确定与阴离子AlH4-空间构型相同的两种离子,以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,根据均摊法可知,晶胞中AlH4-数目为1+8×$\frac{1}{8}$+4×$\frac{1}{2}$=4,Na+数目为6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,则二者配位数相等,若NaAlH4晶胞底心处的Na+被Li+取代,可知晶胞中Li+为1,再计算Na+数目,而晶胞中AlH4-数目不变,可得化学式;
解答 解:AlH4-中Al的轨道杂化数目为4+$\frac{3+1-1×4}{2}$=4,Al采取sp3杂化,为正四面体构型,与AlH4-空间构型相同的两种离子为NH4+、BH4-、NH4+、SO42-等,根据均摊法可知,晶胞中AlH4-数目为1+8×$\frac{1}{8}$+4×$\frac{1}{2}$=4,Na+数目为6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,则二者配位数为1:1,以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,则与Na+紧邻且等距的AlH4-有8个,若NaAlH4晶胞底心处的Na+被Li+取代,可知晶胞中Li+为1,Na+数目为3,而晶胞中AlH4-数目不变,可得化学式Na3Li[AlH4]4,
故答案为:NH4+、BH4-、NH4+、SO42-等;8;Na3Li[AlH4]4;
点评 本题是对物质结构与性质的考查,涉及杂化方式与空间构型、晶胞结构与计算等,侧重考查学生对知识的迁移应用,难度中等.


科目:高中化学 来源: 题型:解答题
| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2是氧化产物 | |
| B. | KClO3在反应中发生还原反应 | |
| C. | 生成5.6LCO2,转移的电子数目为0.25NA | |
| D. | 24.5g KClO3参加反应,转移电子物质的量为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 2:7 | C. | 1:2 | D. | 8:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期元素X、Y、Z、W、R、Q的原子序数依次增大,X的核外电子总数与其周期数相同;Y有三个能级,且每个能级上的电子数相等;Z原子单电子数在同周期元素中最多;W与Z同周期,第一电离能比Z的低;R与Y同一主族,Q的最外层电子数为2,其他电子层电子均处于饱和状态.请回答下列问题:
前四周期元素X、Y、Z、W、R、Q的原子序数依次增大,X的核外电子总数与其周期数相同;Y有三个能级,且每个能级上的电子数相等;Z原子单电子数在同周期元素中最多;W与Z同周期,第一电离能比Z的低;R与Y同一主族,Q的最外层电子数为2,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
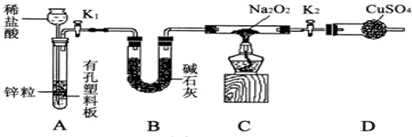 钠的化合物在工农业生产和人们的日常生活中有着广泛的应用,其中Na2O2常用作漂白剂和潜水艇中的供氧剂.Na2O2有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能反应.为了验证此推测结果,该同学设计并进行如下实验,实验步骤和现象如下.
钠的化合物在工农业生产和人们的日常生活中有着广泛的应用,其中Na2O2常用作漂白剂和潜水艇中的供氧剂.Na2O2有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能反应.为了验证此推测结果,该同学设计并进行如下实验,实验步骤和现象如下.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | Mg2+ | C. | Fe2+ | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
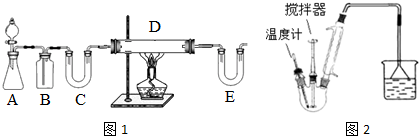
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com