
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向CuSO4溶液中通入H2S气体,出现黑色沉淀 | H2S的酸性比H2SO4强 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| C | 蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制氢氧化铜悬浊液,水浴加热,未出现红色沉淀 | 蔗糖未水解 |
| D | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 检验制得气体是否为乙烯 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
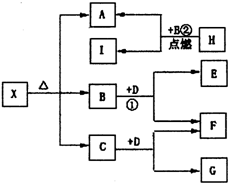 已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.
已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、香芹酮化学式为C9H12O |
| B、香芹酮可以发生加成反应、消去反应和氧化反应 |
| C、香芹酮能使酸性KMnO4溶液退色 |
| D、香芹酮分子中有3种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F为前四周期原子序数依次增大的非稀有气体元素.其中:A的一种单质是自然界最硬的物质;B与A同周期且基态原子中s能级与p能级上的电子数相等;C于B同主族;D为同周期电负性最大的元素;E为使用最为广泛的金属;F的基态原子中没有单电子.请回答下列有关问题:
A、B、C、D、E、F为前四周期原子序数依次增大的非稀有气体元素.其中:A的一种单质是自然界最硬的物质;B与A同周期且基态原子中s能级与p能级上的电子数相等;C于B同主族;D为同周期电负性最大的元素;E为使用最为广泛的金属;F的基态原子中没有单电子.请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 -COOCH2CH3
-COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大.X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态.请回答下列问题:
已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大.X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Q | I1 | I2 | I3 | I4 | I5 | … |
| 电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com