
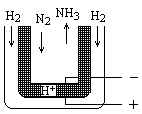
氨是最重要的氮肥原料。在课本里学到的合成氨技术叫哈伯法,近一个世纪,合成氨需要高温高压似乎是天经地义了。然而,最近有两位希腊化学家在《科学》杂志上发表文章说,在常压下把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池(如图),氢气和氮气便可在电极上合成氨,转化率竟然高达78%。
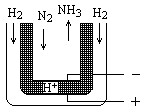
请根据以上材料回答下列问题:
(1)写出哈伯法合成氨的化学方程式: ;其反应条件中,符合平衡移动原理的反应条件是
(2)新法合成氨的电解池中能否用水溶液作电解质? (填“能”、“不能”)
为什么?
(3)电解池中,阳极发生 (填得或失)电子氧化反应,变价元素化合价 (填升高或降低)
(4)新法合成氨中所用的电解质(如图中黑细点所示)能传导H+,试写出电极反应式和总反应式。阳极: ;阴极___________________________
总反应式:__________________________________。
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2008届宁夏省中卫一中高三第二学期第一次模拟、理科综合试卷化学部分 题型:022
(化学与技术)氨是最重要的氮肥,是产量最大的化工产品之一,其合成原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 KJ/moL.试回答下列问题:
2NH3(g) ΔH=-92.4 KJ/moL.试回答下列问题:
氨的合成是一个可逆反应,为了探索合成氨的最佳条件,人们进行了大量的研究.
(1)下列有关做法不适宜的是________
A、常采用循环法,使未转化的氮气和氢气得到充分的利用.
B、综合考虑各方面的因素,压强控制在20-50 MPa之间为宜
C、利用电解水制氢气,作为合成氨的原料,
D、使用铁触媒为催化剂,在500℃时获得最大催化效益.
(2)合成氨工业中采取的下列措施可用勒夏特列原理解释的是________(填序号)
A、采用较高压强(20-50 MPa)
B、采用500℃的高温
C、用铁触媒为催化剂
D、将生产的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(3)在298 K时,将10 moL N2和30 moL H2放入合成塔中,为何放出的热量小于924 KJ?
(4)怎样知道在合成氨工业有氨气生成?
(5)如果提高单位时间内氨气的产量,对温度而言,在________(填高温或低温)下有利.
查看答案和解析>>
科目:高中化学 来源:北京期末题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是最重要的氮肥,是产量最大的化工产品之一,其合成原理为
N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4KJ/moL。试回答下列问题:
2NH3(g) △H=-92.4KJ/moL。试回答下列问题:
氨的合成是一个可逆反应,为了探索合成氨的最佳条件,人们进行了大量的研究。
(1) 下列有关做法不适宜的是( )
A、常采用循环法,使未转化的氮气和氢气得到充分的利用。
B 、综合考虑各方面的因素,压强控制在20―50MPa之间为宜
C、利用电解水制氢气,作为合成氨的原料,
D、使用铁触媒为催化剂,在5000C时获得最大催化效益。
(2)合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A 、采用较高压强(20―50MPa)
B、采用5000C的高温
C、用铁触媒为催化剂
D、将生产的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(3)在298K时,将10moL N2和30moL H2放入合成塔中,为何放出的热量小于924KJ?
(4)怎样知道在合成氨工业有氨气生成?
如果提高单位时间内氨气的产量,对温度而言,在 (填高温或低温)下有利.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com