
| A. | 16mol | B. | 6mol | C. | 12mol | D. | 4mol |
分析 反应3Cl2+8NH3=6NH4Cl+N2中,Cl元素化合价由0价降低到-1价,被还原,Cl2为氧化剂,N元素化合价由-3价升高到0价,被氧化,NH3为还原剂,结合元素化合价的变化和反应的方程式解答该题.
解答 解:反应3Cl2+8NH3=6NH4Cl+N2中,Cl元素化合价由0价降低到-1价,被还原,Cl2为氧化剂,N元素化合价由-3价升高到0价,被氧化,则转移电子的物质的量为2mol×6=12mol,
故选C.
点评 本题以氯气与氨气反应的性质为载体考查氧化还原反应知识,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握反应的特点,从元素化合价的角度认识,难度不大.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案科目:高中化学 来源: 题型:实验题
 )原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
)原料,制取苯甲酸甲酯,已知有关物质的沸点如表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
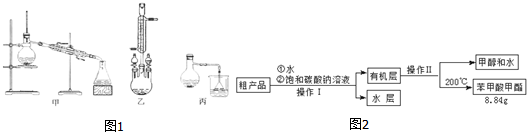
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨工业上增大压强以提高反应物的转化率 | |
| B. | 黄绿色的氯水光照后颜色变浅 | |
| C. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| D. | 在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{\sqrt{a}}$ | B. | $\sqrt{a}$ | C. | $\frac{1}{2}$a | D. | $\frac{1}{\frac{1}{2}a}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com