
分析 根据n=$\frac{m}{M}$,N=nNA,V=nVm,结合分子构成计算.
解答 解:令气体的质量分别为1g,
A.O2 则分子的物质的量n=$\frac{m}{M}$=$\frac{1}{32}$mol,体积为V=nVm=$\frac{Vm}{32}$L,原子的物质的量为$\frac{1}{16}$mol,
B.CO2 则分子的物质的量n=$\frac{m}{M}$=$\frac{1}{44}$mol,体积为V=nVm=$\frac{Vm}{44}$L,原子的物质的量为$\frac{3}{44}$mol
C.H2 则分子的物质的量n=$\frac{m}{M}$=$\frac{1}{2}$mol,体积为V=nVm=$\frac{Vm}{2}$L,原子的物质的量为1mol
D.CH4 则分子的物质的量n=$\frac{m}{M}$=$\frac{1}{16}$mol,体积为V=nVm=$\frac{Vm}{16}$L,原子的物质的量为$\frac{5}{16}$mol
E.Cl2则分子的物质的量n=$\frac{m}{M}$=$\frac{1}{71}$mol,体积为V=nVm=$\frac{Vm}{71}$L,原子的物质的量为$\frac{2}{71}$mol
所以分子数最多的是C;体积最小的是E;原子数最多的是C;
故答案为:C;E;C.
点评 本题考查物质的量的有关计算,题目难度不大,注意物质的量与质量、体积、微粒数目、物质的量浓度之间的计算公式的运用.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/min | 1 | 2 | 4 | 6 | 8 |
| X物质的量/mol | 1.5 | 1.2 | 1.0 | 0.9 | 0.9 |
| A. | 增加Y的质量,反应速率一定加快 | |
| B. | 0~4min段Z的平均速度为$\frac{3}{8}$mol•L-1•min-1 | |
| C. | 2~4min段X的平均速度为$\frac{1}{10}$mol•L-1•min-1 | |
| D. | X、Y的反应速率一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
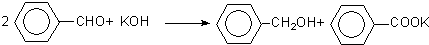
| 物质 | 沸点 | 熔点 | 溶解性 |
| 苯甲醛 | 179℃ | -26℃ | 微溶于水,能与乙醚混溶. |
| 苯甲醇 | 205.3℃ | -15.3℃ | 稍溶于水,能与乙醚混溶 |
| 苯甲酸 | 249℃ | 122℃ | 微溶于水,易溶于乙醚. |
| 乙醚 | 34.8℃ | 难溶于水 |

| 序号 | 实验方案 | 实验现象 | 结论 |
| 步骤① | 取少量产品甲于洁净的试管中,再加入2mLAg(NH3)OH 溶液,水浴加热. | 试管内壁产生光亮银镜 | 产品甲中含有苯甲醛 |
| 步骤② | 将少量产品甲置于分液漏斗中,然后向漏斗中加入饱和NaHSO3溶液,溶液,充分反应后分液. | ||
| 步骤③ | 将步骤②的有机层洗涤、干燥后,测定产品的 沸点 | 沸点为205.3℃ | 所得有机层是纯净的苯甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取代反应和置换反应中一定都有单质生成 | |
| B. | 取代反应的反应物一定都是有机物,置换反应的反应物一定都是无机物 | |
| C. | 取代反应大多是可逆的,反应速率慢,而置换反应一般是单向进行的,反应速率快 | |
| D. | 取代反应和置换反应的产物都是唯一的,不会有多种产物并存的现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com