
下列方法中可以说明2HI(g)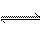 H2(g)+I2(g)已达到平衡的是( )
H2(g)+I2(g)已达到平衡的是( )
①单位时间内生成n mol H2的同时生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分组成w(HI)=w(I2)
④反应速率v(H2)=v(I2)=1/2v(HI)时
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1时
⑥温度和体积一定时,容器内压强不再变化
⑦温度和体积一定时,某一生成物浓度不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
A.②③⑤ B.①④⑦ C.②⑦⑨ D.⑧⑨⑩
科目:高中化学 来源: 题型:
已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为________。
a.大于7 b.等于7 c.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为________mol/L,B溶液中水电离出的氢离子浓度为________mol/L。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液与铝粉反应产生氢气,此溶液中一定能大量共存的离子组是( )
A.K+、Cl-、I-、SO42- B.S2O32-、Na+、K+、NO3-
C.Cu2+、Na+、Mg2+、AlO2- D.H2PO4-、NH4+、Ag+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式中的反应热下划线处表示燃烧热的是( )
A.C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(g);ΔH=-akJ·mol-1
6CO2(g)+6H2O(g);ΔH=-akJ·mol-1
B.CH3CH2OH(l)+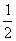 O2(g)
O2(g) CH3CHO(l)+H2O(l);ΔH=-bkJ·mol-1
CH3CHO(l)+H2O(l);ΔH=-bkJ·mol-1
C.CO(g)+ 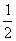 O2(g)
O2(g)
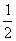 CO2(g);ΔH=-c kJ·mol-1
CO2(g);ΔH=-c kJ·mol-1
D.NH3(g)+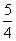 O2(g)
O2(g) NO(g)+
NO(g)+ H2O(g);ΔH=-d kJ·mol-1
H2O(g);ΔH=-d kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A(g) + 3B(g)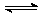 2C(g) + 2D(g),下列反应速率最大的是( )
2C(g) + 2D(g),下列反应速率最大的是( )
| A.v(D)=0.4 mol·L—1·s—1 | B.v (C)=0.5 mol·L—1·s—1 |
| C.v (B)=0.6 mol·L—1·s—1 | D.v (A)=0.15 mol·L—1·s—1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一固定容积的密闭容器中通入4molX气体和6molY气体,同时发生如下反应:X(气)+nY(气) 2R(气)+Q(气)反应达到平衡时,测得X和Y的转化率分别25%和50%,则n的值为( )
2R(气)+Q(气)反应达到平衡时,测得X和Y的转化率分别25%和50%,则n的值为( )
A、1 B、2 C、3 D、4
查看答案和解析>>
科目:高中化学 来源: 题型:
为了完成教材上的“中和热的测定”这个实验
(1)实验桌上有烧杯(大、小两个)、泡沫橡胶、泡沫塑料板、环形玻璃搅拌器,0.5mol·L-1盐酸、0.55mol·L—1NaOH溶液,尚缺少的实验用品是 。
(2)实验中能否用环形铜丝搅拌器代替环形玻璃搅拌器?答: (填“能”或“否”)。其原因是 。
(3) 实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g·cm—3,生成溶液的比热容c=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式: 。
(4)在下列仪器选择时,不是为了避免测量误差的是 。
A.两个烧杯 B.两个量筒 C.温度计 D.塑料盖板 E.泡沫塑料
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
 Na2O2(s)+CO2(g)=Na2CO3(s)+
Na2O2(s)+CO2(g)=Na2CO3(s)+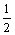 O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
人体中胃酸的主要成分是盐酸。胃酸可帮助消化食物,但胃酸过多会使人感到不适,服用适量的小苏打可使症状明显减轻。
(1)写出小苏打和盐酸反应的离子方程式: ;
(2)Mg(OH)2也是一种胃酸中和剂,写出Mg(OH)2中和胃酸的离子方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com