
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源:不详 题型:单选题
 2NH3下列各项所表示的反应速率最快的是
2NH3下列各项所表示的反应速率最快的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.①④ | C.②③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.=0.015 mol (L·s) -1② v | B.=0.06 mol (L·s) -1 ③v | C.=2.4 mol (L·min ) -1④ v | D.=0.045mol (L·s) -1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2NH3(g);在2 min时达到平衡状态,此时c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。
2NH3(g);在2 min时达到平衡状态,此时c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度/mol·L-1[ | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol·L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | — | — | — |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 来总物质的量分数为
来总物质的量分数为 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
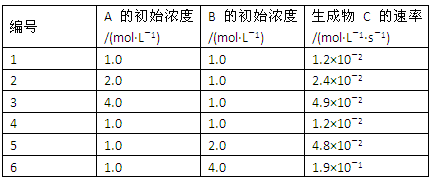
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,在2L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。
,在2L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。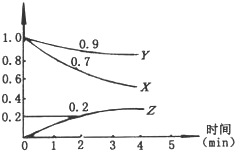
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com