(1)1mol不同固体物质的体积各不相同,其原因是:①
固体微粒间的平均距离相对微粒大小可忽略,而不同的固体微粒大小不同,所以1mol不同固体物质的体积各不相同
固体微粒间的平均距离相对微粒大小可忽略,而不同的固体微粒大小不同,所以1mol不同固体物质的体积各不相同
,在同温同压时任何气体间一定几乎相同的是②
分子间的平均距离
分子间的平均距离
.
(2)在下列反应方程式中标明电子转移的方向和数目(单线桥)(该反应中H
2O
2只发生如下变化过程:H
2O
2→O
2)③
2H
2CrO
4+3H
2O
2=2Cr(OH)
3+3O
2↑+2H
2O 此反应中若生成标准状况下氧气6.72L,则转移电子的物质的量为④
0.6mol
0.6mol
(3)在物质分类中硫酸氢钠除属于钠盐、可溶性盐、硫酸氢盐外还可划分为⑤
酸式或含氧酸
酸式或含氧酸
盐.
(4)一定条件下NaHSO
4与Ba(OH)
2反应的离子反应可写为:
H
++SO
42-+Ba
2++OH
-=BaSO
4↓+H
2O,则所得溶液呈⑥
碱性
碱性
性(酸性或碱性),若要所得溶液呈中性则继续反应的离子方程式为⑦
H++OH-=H2O
H++OH-=H2O
(5)氧化还原反应是由氧化反应和还原反应组成的对立统一体如:
3Cu+8HNO
3=3Cu(NO
3)
2+2NO↑+4H
2O 氧化:3Cu-6e
-=3Cu
2+;还原:2NO
3-+6e
-+8H
+=2NO↑+4H
2O试写出铝投入氢氧化钠溶液中发生反应的离子方程式⑧
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
,可拆分成氧化和还原过程:氧化:2Al-6e
-+8OH
-=2AlO
2-+4H
2O,试写出 还原:⑨
6H2O+6e-=3H2+6OH-
6H2O+6e-=3H2+6OH-
.

 2H2O+O2
2H2O+O2 CaO+CO2
CaO+CO2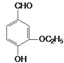 是食品添加剂的增香原料,其香味比香草醛更加浓郁.
是食品添加剂的增香原料,其香味比香草醛更加浓郁.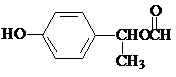 或
或
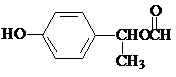 或
或
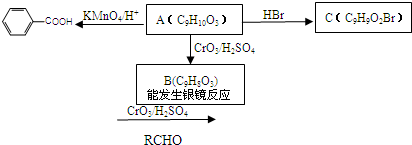
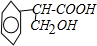
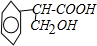



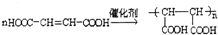
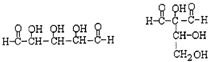
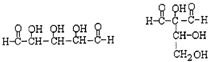
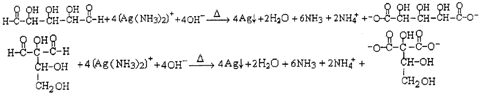
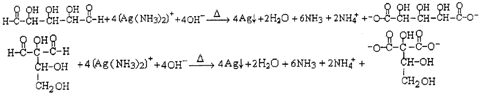


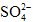 ; ②Na+、Mg2+、Cl-、
; ②Na+、Mg2+、Cl-、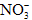 ; ③K+、Ba2+、Cl-、
; ③K+、Ba2+、Cl-、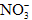 ;
; 

