
| A. | 残留固体是2mol Na2CO3 | |
| B. | 残留固体是 Na2CO3和NaOH的混合物 | |
| C. | 反应中转移2mol电子 | |
| D. | 排出的气体是1.5mol氧气 |
分析 根据反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O可知,2mol NaHCO3分解得到Na2CO3、CO2和H2O各1mol,
还会发生反应:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2,由于二氧化碳与氢氧化钠反应生成碳酸钠,可以认为过氧化钠先与二氧化碳反应,再与水反应,Na2O2只有1mol,恰好和CO2反应生成1molNa2CO3和O2,气体排出后,只剩余Na2CO3,碳酸钠的总物质的量为:1mol+1mol=2mol;反应中排出的气体为0.5mol氧气和1mol水蒸气,据此对各选项进行判断.
解答 解:由方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,可知2mol NaHCO3分解得到Na2CO3、CO2和H2O各1mol,
还会发生反应:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2,由于二氧化碳与氢氧化钠反应生成碳酸钠,可以认为过氧化钠先与二氧化碳反应,再与水反应,Na2O2只有1mol,恰好和CO2反应生成1molNa2CO3和O2,气体排出后,只剩余Na2CO3,碳酸钠的总物质的量为:1mol+1mol=2mol,
A.根据分析可知,残留固体为2mol碳酸钠,故A正确;
B.残留固体为碳酸钠,不含氢氧化钠,故B错误;
C.过氧化钠中氧元素的化合价为-1价,1mol过氧化钠反应生成0.5mol氧气,转移了1mol电子,故C错误;
D.排出的气体为0.5mol氧气和1mol水,故D错误;
故选A.
点评 本题考查混合物反应的计算、化学方程式有关计算,题目难度中等,明确发生反应原理为解答关键,注意理解“过氧化钠先与二氧化碳反应,再与水反应”,为易错点.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| D. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是利用化学原理对环境污染进行治理 | |
| B. | 自来水可用氯气来杀菌消毒.说明氯气无毒 | |
| C. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
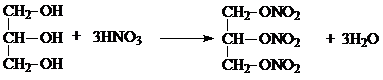 .
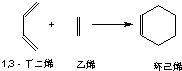
.
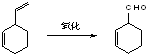
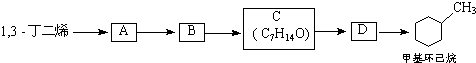
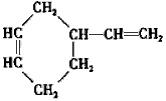 ;B
;B
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸 | |
| B. | 通过改变温度和浓度等条件,利用平衡移动原理制取HCl | |
| C. | 两种强酸混合,溶解度会相互影响,低溶解度的物质析出 | |
| D. | 浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
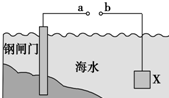
| A. | 当a、b间用导体连接时,则X应发生氧化反应 | |
| B. | 当a、b间用导体连接时,则X可以是锌或石墨 | |
| C. | 当a、b与外接电源相连时,a应连接电源的正极 | |
| D. | 当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e→Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Fe2+):c(Fe3+)=3:1 | B. | c(Fe3+):c(Cu2+)=4:3 | ||
| C. | c(CI-)=6mol/L,c(Fe2+)=0.6mol/L | D. | 该绝缘板腐蚀后质量减少0.384g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com