
请回答下列问题:
(1)①现有0.1mol/L的纯碱溶液,若用pH试纸测定溶液的pH,其正确的操作是 。
②纯碱溶液呈碱性的原因是(用离子方程式表示) 。
(2)①已知4.4g丙烷完全燃烧生成二氧化碳气体和液态水,并放出222.0kJ的热量,请写出反应的热化学方程式: 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol,实验测得甲烷与丙烷的混合气体1mol完全燃烧生成液态水和二氧化碳气体时,放热1776.7kJ,则混合气体中甲烷与丙烷的体积比为 。
科目:高中化学 来源: 题型:
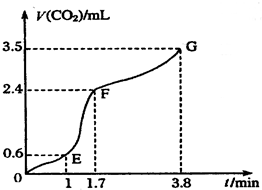 Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| m | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com