
下列各表述与示意图一致的是

A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2 (g) + O2(g)  2SO3(g) ΔH < 0 ,正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH < 0 ,正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)→CH3CH3(g) ΔH<0使用(a)和未使用(b)催化剂时,反应过程中的能量变化
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在25℃时,将两个铜电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,
阴极逸出a mol气体,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中
溶质质量分数是( )。

查看答案和解析>>
科目:高中化学 来源: 题型:
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2 2NH3 △H= - 92.4kJ/mol
2NH3 △H= - 92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
此温度下该反应的平衡常数K= 。
②欲提高H2的转化率,下列措施可行的是 。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
 d.液化生成物分离出氨
d.液化生成物分离出氨
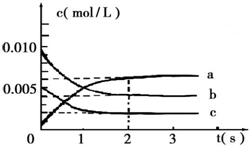
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)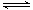 2NO2(g) △H<0体系中,各成分浓度随时间的变化如右图:
2NO2(g) △H<0体系中,各成分浓度随时间的变化如右图:
①用O2表示从0~2s内该反应的平均速率
v=___________。
②能说明该反应已经达到平衡状态的是
_________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
4CO(g)+2NO2(g)  4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应2NO2 2NO+O2在恒容的密闭容器中反应,达到平衡状态的标志是:
2NO+O2在恒容的密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成n molO2的同时生成2n molNO2 ②用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态 ③混合气体的颜色不再改变的状态 ④混合气体的密度不再改变的状态 ⑤混合气体的平均相对分子质量不再改变的状态
A. ①③⑤ B. ①④⑤ C. ①③④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生为测定某氨水中NH3∙H2O的物质的量浓度,进行如下实验(已知硫酸铵溶液呈弱酸性):
I.将浓度为0.1000 mol·L-1的标准硫酸溶液装入洗涤、润洗后的酸式滴定管中,调节液面,记录读数;
II.用碱式滴定管移取20.00 mL待测液于锥形瓶中,并滴几滴甲基橙指示剂;
III.在锥形瓶下垫一张白纸,滴定,记录读数。
IV.再重复上述操作两次。
试填空:
(1)装入标准溶液后,调节液面之前应进行的操作是 ;
(2) III步操作中的锥形瓶下垫一张白纸的作用是 ;
(3)滴定过程发生反应的离子方程式为: ,判断滴定终点依据的实验现象是 ;
(4)硫酸溶液读数如下表所示,按所得数据可得氨水中NH3∙H2O的物质的量浓度为__________。
| 滴定前 | 滴定后 | |
| 第一次 | 0.70 | 16.15 |
| 第二次 | 0.05 | 16.35 |
| 第三次 | 0.35 | 15.70 |
(5)下列操作中会使所测NH3∙H2O的物质的量浓度偏低的是__________。
a.I步操作中未用标准酸溶液润洗滴定管
b.I步操作中改用酚酞试液做酸碱指示剂
c.II步操作中用待测液润洗锥形瓶
d.III步操作后发现滴定管尖嘴部有气泡且未处理
e.读取硫酸体积时,开始时仰视读数,结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.1mol NaCl中含有6.02×1023个NaCl分子
B.欲配制1L1mol.L-1的NaCl溶液,可将 58.5gNaCl溶于 1L水
C.含有2×6.02×1023个阴离子的CaC2,在标准状况下能产生约44.8L的乙炔气体
D.1molCl2与足量的铁反应,转移的电子数为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)SO2气体与Fe3+反应的主要产物是_____________、 。(填离子符号)
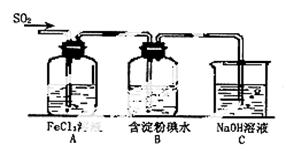 (2)下列实验方案可以用于在实验室制取所
(2)下列实验方案可以用于在实验室制取所
需SO2的是 。
A.Na2SO3溶液与HNO3
B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是 。
(4)如果有280mL SO2气体(已折算为标态)
进入C装置中,则C中,50mL NaOH溶液
的浓度至少为 mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A
中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的还原性弱于SO2的现象是 ,
写出有关离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同,且SO42- 的物质的量浓度为6 mol·L-1,则此溶液最多溶解铁粉的质量为( )
A.5.6 g
B.11.2 g
C.22.4 g
D.33.6 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com