
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白。亚氯酸钠![]() 在溶液中可生成
在溶液中可生成![]() 、
、![]() 、
、![]() 、
、![]() 等,其中
等,其中![]() 和
和![]() 都具有漂白作用,但
都具有漂白作用,但![]() 是有毒气体;经测定,
是有毒气体;经测定,![]() 时各组分含量随pH变化情况如图所示
时各组分含量随pH变化情况如图所示![]() 没有画出
没有画出![]() 则下列分析正确的是( )
则下列分析正确的是( )

A.亚氯酸钠在酸性条件下较稳定
B.![]() 时,
时,![]() 的电离平衡常数的数值
的电离平衡常数的数值![]()
C.pH越大,该漂白剂的漂白性能越好
D.![]() ,
,![]() 时,
时,![]() 溶液中:
溶液中:![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】往xg铁铜的混合粉末中加入一定体积某浓度的2.00mol·L-1FeCl3溶液,充分反应后剩余固体的质量与加入FeCl3溶液的体积存在如下关系:
加入FeCl3溶液体积(mL) | 100 | 200 | 300 | 400 |
剩余固体质量(g) | 14.8 | 9.20 | 3.20 | 0 |
下列说法不正确的是
A.x=20.6
B.加入FeCl3溶液300mL充分反应后,剩余固体只有Cu
C.混合粉末中Fe和Cu质量之比为35:16
D.加入FeCl3溶液400mL充分反应后的溶液,还能溶解铁粉8.40g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近几年我国已加大对氮氧化物排放的控制力度。消除氮氧化物污染有多种方法。
(l)用CH4还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
②CH4(g)+4NO (g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
③H2O(g)= H2O(l) △H=-44.0kJ·mol-1
CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式为_________________。
(2)用活性炭还原法也可处理氮氧化物。有关反应为:2C(s)+2NO2(g)=N2(g)+2CO2(g) △H<0,起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。

①010min内,以CO2表示的平均反应速率v(CO2)=_______________。
②0~10min,1020 min,3040 min三个阶段NO2的转化率分别为α1、α2、α3,其中最小的为_________,其值是___________________。
③计算反应达到第一次平衡时的平衡常数K=____________。
④第10min时,若只改变了影响反应的一个条件,则改变的条件为______(填选项字母)。
A.增加C(s)的量 B.减小容器体积 C.加入催化剂
⑤20~30min、4050 min时体系的温度分别为T1和T2,则T1_____T2(填“> “<”或“=”), 判断的理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中X、Y、W、Z为知周期元素,T的单质常温下为液体。下列说法错误的是

A. X、Y的单质均存在同素异形体
B. Y、Z的简单氢化物的稳定性依次递增
C. 工业上电解NaW溶液得W2可使用阴离子交换膜
D. R的单质可用于制造半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是(相对原子质量:H-1、O-16)
A.11.2LNH3所含分子数为0.5nA
B.1molCl2与足量Fe反应,转移的电子数为3nA
C.100mL1mol/LFeCl3溶液中含Fe3+微粒的数目是0.1nA
D.常温下,34gH2O2中H-O键数目为2nA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象与文字描述正确的是
A.根据图可判断对于“![]() ”:升温,化学反应平衡常数增大
”:升温,化学反应平衡常数增大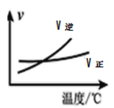
B.图表示压强对可逆反应![]() 的影响且
的影响且![]()
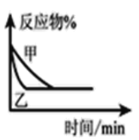
C.图可表示醋酸溶液中通入氨气至过量过程中溶液导电性的变化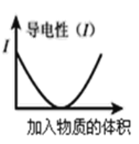
D.根据图,若除去![]() 溶液中的
溶液中的![]() 可采用向溶液中加入适量
可采用向溶液中加入适量![]() 至溶液的pH在4左右即可
至溶液的pH在4左右即可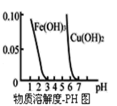
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为原料合成化合物C的流程如图所示:
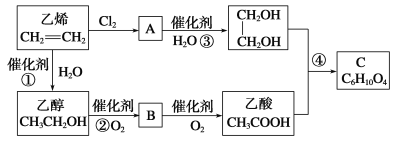
(1)①③的反应类型分别为___反应和___反应。
(2)写出反应③和④的化学方程式:
③____;④___。
(3)写出B与银氨溶液反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的N2(g)和02(g)反应生成NO(g)过程中的能量变化情况判断,下列说法正确的是

A.N2(g)和O2(g)反应生成NO(g)是放热反应
B.2 mol O原子结合生成O2(g)时需要吸收498 kJ能量
C.1 mol NO(g)分子中的化学键断裂时需要吸收632 kJ能量
D.2 mol N(g)和2 mol O(g)的总能量为1444 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得平衡后n(Cl2)=2.5×10-2 mol,10 min内υ(ClNO)=________________,则NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2 ________α1(填“>”、“<”或“=”),
(3)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I. 4NH3(g) + 5O2(g)![]() 4NO(g) + 6H2O(g) △H =-906 kJ·mol-1
4NO(g) + 6H2O(g) △H =-906 kJ·mol-1
II.4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g) △H = -1266 kJ·mol-1
在1L的密闭容器中充入1 mol NH3和2 mol O2,测得有关物质的物质的量与反应温度的关系如图所示。

①催化氧化步骤中,最适宜的温度为_________________(填“T1”或“T2” 或“T3”)
②写出N2和O2生成NO的热化学方程式________。
③温度为T2时,反应II的平衡常数K =_________________(只列算式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com