
【题目】 双酚A是一种重要的化工原料,它的一种合成路线如下图所示:
双酚A是一种重要的化工原料,它的一种合成路线如下图所示:
 下列说法正确的是
下列说法正确的是
A. 1mol双酚A最多可与2molBr2反应
B. G物质是乙醛的同系物
C. E物质的名称是1-溴丙烷
D. 反应③的化学方程式是![]()
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】常温下,把0.02 mol/L CH3COOH(Ka=1×10-5 mol/L)溶液和0.01 mol/L NaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是
A. c(CH3COO-)>c(Na+) B. c(CH3COOH)>c(CH3COO-)
C. c(H+)<c(OH-) D. c(CH3COOH)+c(CH3COO-)=0.02 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、CO(NH2)2 (尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。

(1)如图表示用石墨作电极,在一定条件下电解饱和食盐水制取Cl2时,阳极上产生也会产生少量的ClO2的电极反应式:________________________________;电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________mol。
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
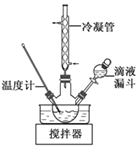
(3)步骤Ⅱ合成N2H4·H2O的装置如下图所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_________________;使用冷凝管的目的是_________________________________。
(4)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3,欲测定亚硫酸钠产品的纯度设计如下实验方案,并进行实验。准确称取所得亚硫酸钠样品m g于烧杯中,加入适量蒸馏水配成100 mL待测溶液。移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1酸性KMnO4标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(假设杂质不反应)。样品中亚硫酸钠的质量分数为__________(用含m、c、V的代数式表示)。某同学设计的下列滴定方式中,合理的是________(夹持部分略去)(填字母序号)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50mL KMnO4标准溶液的过程示意图。


(1)请你观察图示判断,其中不正确的操作有__________(填序号)。
(2)如果用图示的操作配制溶液,所配制的溶液浓度将__________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(3)已知草酸跟KMnO4溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mnx++10CO2↑+8H2O则方程式中的x=__________。
(4)经过计算,血液样品中Ca2+的浓度为__________mg·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,下列物质不能与二氧化硅反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤高氯酸 ⑥氢氧化钾 ⑦氧化钙⑧ 氮气
A.③⑤⑦⑧B.⑤⑦⑧C.⑤⑧D.⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L(标准状况下)某气态烃,完全燃烧生成的CO2和水蒸气在273 ℃、1.01×105 Pa下体积为y L,当冷却至标准状况时体积为x L。下列用x、y表示该烃的化学式正确的是
A. CxHy-2x B. CxHy-x C. CxH2y-2x D. CxHy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都为短周期元素,它们在周期表中的位置如图所示。已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C符合的一组是( )

A.铍、钠、铝B.硼、镁、硅C.碳、铝、磷D.氧、磷、氯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校实验室过氧化钠因保存不当变质,课外活动小组称取a g样品,设计用如图装置来测定过氧化钠质量分数。

(1)将仪器连接好后,进行的第一步操作是_________。
(2)B装置出来的气体是否需要干燥_____________(填“是”或“否”)。
(3)写出装置C中发生的主要反应化学方程式__________。
(4)D中NaOH溶液的作用________。
(5)实验结束时,读取实验中生成气体的体积时,不合理的是__________。
a.直接读取气体体积,不需冷却到室温。
b.上下移动量筒,使得E、F中液面高度相同。
c.视线与凹液面的最低点相平读取量筒中水的体积。
(6)读出量筒内水的体积后,折算成标准状况下氧气的体积为V L,则样品中过氧化钠的质量分数为_____________。(用含a和V的代数式表示)
(7)实验完成后E到F之间导管内残留水的体积会使测量结果________(填“偏大”“偏小”“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色反应均为黄色。

请填写下列空白:
(1)写出化学式:
A___________、B__________、C ___________、D __________。
(2)以上反应中属于氧化还原反应的有_________________。(填写编号)
(3)写出A→C反应的离子方程式____________________________________________;E→D的化学方程式_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com