
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:
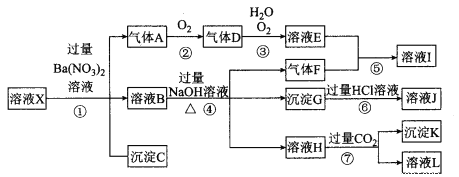
(1)依题意不进行实验即可判断溶液X中一定不存在的离子有 。
(2)下列结论正确的是 (填序号)。
A.X中肯定存在Fe2+、Al3+、NH4+
B.气体F经催化氧化可直接生成气体D
C.沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀K可能有Al(OH)3
D.溶液X中,一定没有NO3-
(3)产生气体A的离子方程式为 。
(4)转化⑥发生反应的现象为 。
(5)转化③中氧化剂与还原剂的物质的量之比为 。
(6)对不能确定是否存在的离子,如何确定其是否存在? (简述操作过程)
【答案】(1)CO32-、SiO32-
(2)CD(3)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(4)红褐色沉淀溶解,溶液变为黄色(5)1:4
(6)可以另取X溶液,先加入KSCN溶液,若溶液变为血红色则有Fe3+,再向溶液中逐滴加入NaOH溶液,有沉淀生成,持续滴加过量NaOH,沉淀减小但不消失则有Al3+
【解析】
试题分析:某强酸性溶液X,则溶液中不存在弱酸根离子CO32-、SiO32-,溶液和硝酸钡溶液反应生成沉淀C,则溶液一定存在SO42-,不存在和硫酸根离子反应的Ba2+,C是BaSO4;酸性条件下硝酸根离子具有强氧化性,所以溶液中Fe2+和NO3-不能共存,加入硝酸钡产生气体,则溶液中存在Fe2+,不存在NO3-,A是NO;溶液B中加入氢氧化钠溶液时,产生气体F,则溶液中含有NH4+,F是NH3,产生沉淀,则溶液中存在Fe3+,沉淀G是Fe(OH)3,氢氧化铁和盐酸反应生成FeCl3,则J是FeCl3,溶液H中通入二氧化碳生成沉淀,开始加入硝酸钡溶液引入了钡离子,该沉淀为BaCO3 ,若原溶液中存在Al3+,沉淀K中也有Al(OH)3,溶液L是碳酸钠或NaHCO3;A是NO,则D是NO2,二氧化氮化和水反应生成硝酸和NO,则E是HNO3,硝酸和氨气反应生成硝酸铵,则I是NH4NO3。
(1)由强酸性条件即可判断溶液X中一定不存在弱酸根离子,所以不存在的离子有CO32-、SiO32-。
(2)强酸性溶液中硝酸根离子具有强氧化性,如果存在硝酸根离子,则不存在亚铁离子,加入硝酸钡溶液时不能产生气体,所以溶液X中一定没有NO3-,根据上述分析,一定有Fe2+、SO42-、NH4+ ,A项错误、D项正确;气体F为NH3,氨气经催化氧化可生成NO,不能生成NO2,B项错误;C.沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀K可能是Al(OH)3,C项正确;答案选CD。
(3)亚铁离子和硝酸反应生成铁离子、一氧化氮和水,离子反应方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。
(4)氢氧化铁和稀盐酸反应生成氯化铁和水,氢氧化铁为红褐色沉淀,氯化铁溶液呈黄色,所以看到的现象是:红褐色沉淀逐渐溶解,溶液变为黄色。
(5))若转化③中,NO2、H2O、O2三种物质恰好发生化合反应生成HNO3,该反应方程式为:4NO2+2H2O+O2= 4HNO3,则反应中NO2与O2的物质的量之比为4:1。
(6)根据上述分析,溶液中一定不存在CO32-、SiO32-和NO3-,一定存在Fe2+、SO42-、NH4+,可能存在Fe3+或Al3+,对不能确定是否存在的离子,确定其存在与否的操作为另取X溶液,先加入KSCN溶液,若溶液变为血红色则有Fe3+,再向溶液中逐滴加入NaOH溶液,有沉淀生成,持续滴加过量NaOH,沉淀减小但不消失则有Al3+。


科目:高中化学 来源: 题型:
【题目】下列叙述中说明某化学平衡一定发生移动的是
A. 混合体系中气体密度发生变化
B. 正、逆反应速率改变
C. 混合物中各组分的浓度改变
D. 反应物的转化率改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 聚氯乙烯分子中含有碳碳双键
B. 油脂的皂化反应属于加成反应
C. 糖类物质均可直接食用并能被人体吸收
D. 以淀粉为原料可制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.往硝酸银溶液中滴加少量氨水:Ag++2NH3=[Ag(NH3)2]+
B.尼泊金酸(![]() )与NaHCO3溶液反应:
)与NaHCO3溶液反应:
![]()
C.乙醛的银镜反应:CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O
D.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准.表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数.结合表中列出的九种气体,试参与回答下列各题:
选项 | 物质 | 大气中的含量 (体积百分比) | 温室效应指数 |
A | H2 | 2 | 0 |
B | O2 | 21 | 0 |
C | H2O | 1 | 0.1 |
D | CO2 | 0.03 | 1 |
E | CH4 | 2×10﹣4 | 30 |
F | N2O | 3×10﹣5 | 160 |
G | O3 | 4×10﹣5 | 2000 |
H | CCl3F | 2.8×10﹣8 | 21000 |
I | CCl2F2 | 4.8×10﹣4 | 25000 |
(1)下列由极性键形成的极性分子是 .
A.N2 B.O2 C.H2O D.CO2E.CH4
(2)下列说法不正确的是 .
A.N2O与CO2,CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3.CHClFCF3.C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是 .
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如图,下列有关说法正确的是 .
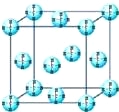
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH446H2O)是在低温高压下形成的晶体
(5)中钴离子在基态时核外电子排布式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有标准状况下的H2、Cl2混合气aL,经光照反应后,所得气体恰好能使b molNaOH完全转变成盐。那么a和b的关系不可能是()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com