
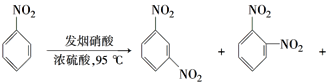
����Ŀ��ijС��������ͼװ�ã��ñ�������FeBr3���������Ʊ��屽��

�� | �� | �屽 | |
�ܶ�/g��cm-3 | 0.88 | 3.10 | 1.50 |
�е�/��C | 80 | 59 | 156 |
ˮ���ܽ��� | �� | �� | �� |
ʵ����̣���a�м���15mL��ˮ����������м����b��С�ļ���4.0mLҺ̬�塣��a�е��뼸���塣��Ӧ���ҽ��С���Ӧֹͣ���������̷����ᴿ��Ʒ��
 ��
��
��1����ƿ���д�������ɫ�������Թ�d�е������ǣ���______________���� ����ˮ��ɻ�ɫ��c��������___________________________________��
��2�������ᴿʱ��������Ϊ______________��������Ϊ_________________��
��3����ˮϴ����Ҫ�õ��IJ���������_________���ձ�����ˮϴ��������ˮ���еμ�KSCN��Һ����Һ���ɫ���Ʋ�ˮϴ����ҪĿ���dz�ȥ__________________��
��4����NaOH��Һϴ��ʱ��Ӧ�Ļ�ѧ����ʽ��________________________��
��5����֪�����巢������ȡ����Ӧ���ƲⷴӦ���Թ�d��Һ�庬�е����ִ���������H+��Br�������ʵ�鷽����֤�Ʋ⡣����ѡ�Լ���Mg��CCl4��AgNO3aq��H2O��
ʵ�鲽�� | Ԥ������ | ���� |
����1�����Թ�d��Һ��ת���Һ©���� __________________________________������ȡ��Һ�ȷֳ����ݣ�����A��B���Թ��У����в���2��3�� | ||
����2�� �� | ֤���� ���� | |
����3�� �� | ֤���� ���� |
���𰸡� ���ܿ��а������� �������� ���� ���� ��Һ©�� FeBr3 2NaOH+Br2 = NaBr+NaBrO+H2O
ʵ�鲽�� | Ԥ������ | ���� |
��������CCl4�������÷�Һ��ȡ�ϲ���Һ���Թ��� | ||
��A�м�������Mg | ������ɫ���� | H+ |
��B�м�������AgNO3��Һ | ����dz��ɫ���� | Br |
����������1����м��Һ�巴Ӧ�����廯��������Һ�����廯���������������¾��ҷ�Ӧ�������屽���廯�⡣�廯��е�ͣ����������ܽ�����ƿ�����ܿ���ˮ�Ӵ������γ���������ƿ�г�������ɫ����ƿ������ˮ��ɻ�ɫ������Ϊ��Ӧ���ȣ�����лӷ��ԣ�����Һ��������������в���Br2(g)������ƿ�С�
�ʴ�Ϊ�����ܿ��а���������
��2����Ӧֹͣ��Ӧ������к����屽�������塢FeBr3�Լ�Fe�������̿�֪������I��õ��������������IӦΪ���ˣ����������ΪFe��������Һ��ˮϴ��Һ��ֲ㣬FeBr3������ˮ����ˮ�㣬���������л���ͱ����屽һ������л��㡣��Һ���з��룬�ټ�NaOH��Һ��ȥ�嵥�ʣ��ٴη�Һ��ˮ������Ҫ����NaBr��NaBrO�ȣ��л����к��б����屽�����ڱ����屽�ķе㲻ͬ���ɽ���������II�����롣
�ʴ�Ϊ�����ˣ�����
��3����������������ˮϴ����õ�ˮ����л��࣬Ϊ��Һ����������Ҫ�ձ��⣬����Ҫ��Һ©��������ˮϴ��������ˮ���еμ�KSCN��Һ����Һ���ɫ��˵��ˮ���д��������ӣ���FeBr3����ˮ������ˮ�ࡣ��ˮϴ��Ŀ��Ϊ��ȥFeBr3��
�ʴ�Ϊ����Һ©����FeBr3��
��4��NaOH��Һϴ��Ŀ��Ϊ��ȥBr2����Ӧ����ʽΪ��2NaOH+Br2 = NaBr+NaBrO+H2O��
��5�������巢��ȡ����Ӧ����Ӧ����HBr������ƿ�У���Һ�к��д�����Br����H+������Br2�ӷ�����ƿ�л��ܽ�������Br2�������Ȼ�̼��ȡ���롣�ֱ�ȡ�����ϲ���ɫ��Һ���Թ�A��B�У��Թ�A�е���������ˮ���û����嵥�ʣ���Һ����ɫ���ɫ��֤������Br�������Թ�B�м�þ�����д������ݲ�����֤������H+���ʴ�Ϊ��
ʵ�鲽�� | Ԥ������ | ���� |
��������CCl4�������÷�Һ��ȡ�ϲ���Һ���Թ��� | ||
��A�м�������Mg | ������ɫ���� | H+ |
��B�м�������AgNO3��Һ | ����dz��ɫ���� | Br |


 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ��辧������Ϣ��������Ҫ���ϡ�
��1����ҵ����ʯӢ�ͽ�̿�����Ƶôֹ衣��֪��Ӧ���̵������仯����ͼ


д����ʯӢ�ͽ�̿��ȡ�ֹ���Ȼ�ѧ����ʽ______________________________��
��2��ijͬѧ������������Ʊ��ߴ��裺

��Y�Ļ�ѧʽΪ____________________��
��д����ӦI�����ӷ���ʽ________________________________________��
��д����ӦIV�Ļ�ѧ����ʽ________________________________________��
�ܼ���ֽ���¶�ԶԶ���ڹ��飨SiH4������ԭ�ӽṹ������ԭ��______________________��
��3�����ֹ�ת�������ȹ��飨SiHCl3������һ����ӦҲ�����Ƶôֹ衣�䷴Ӧ��SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)����ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȵı仯��ϵ��ͼ��ʾ������˵����ȷ����__________������ĸ����
Si(s)+3HCl(g)����ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȵı仯��ϵ��ͼ��ʾ������˵����ȷ����__________������ĸ����

A���÷�Ӧ�Ƿ��ȷ�Ӧ
B���������ʾ��Ͷ�ϱȿ�����![]()
C���÷�Ӧ��ƽ�ⳣ�����¶����߶�����
D��ʵ��������Ϊ���SiHCl3�������ʣ������ʵ�����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ҵ�������CCl4��ķ����ǣ� ��
A. �����Ը��������Һ��������
B. ����������Ũ������ڵ������¼���
C. ������ˮ������
D. ����������Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������E��һ�ֺϳɸ�Ѫѹҩ����м��壬��ϳ�·������ͼ����:

��1��  ����������������Ϊ_____��______��
����������������Ϊ_____��______��
��2�������ϵ���������������ŵ�λ�û����һ����Ӱ�죬��:
 (�����У����������ռ93%)����������Ӧ�Ƶ�A,��һ����Ӧ������Ϊ_________��
(�����У����������ռ93%)����������Ӧ�Ƶ�A,��һ����Ӧ������Ϊ_________��
��3��д��ͬʱ��������������B��һ��ͬ���칹��X�Ľṹ��ʽ: _________��
������������������������6�ֲ�ͬ��ѧ�������⣻
�����������ᷴӦ��������NaHCO3��Һ��Ӧ��
��4���ϳ�Eʱ������������һ����E��Ϊͬ���칹��ĸ�����Y��Y�Ľṹ��ʽΪ______��
��5�������£�������Br2��CCl4��Һ�з���ȡ����Ӧ���õ�һ������д���Ա�����CCl4Ϊԭ���Ʊ� �ĺϳ�·������ͼ(���Լ����ã��ϳ�·������ͼʾ�����������)��______________
�ĺϳ�·������ͼ(���Լ����ã��ϳ�·������ͼʾ�����������)��______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E�dz�����������ʣ�������ת����ϵ(��ȥ��������Ʒ)��

��1����DΪ������CΪNaAlO2��EΪNaOH����Bת��ΪC�����ӷ���ʽΪ_____________��
��2����A��B��C��Ϊ������Һ��AΪNa2CO3��D��E��Ϊ±�ص�������һ��Ϊ����ɫ���壬��E�Ļ�ѧʽΪ_______________��
��3����B��D��Ϊ������С��18��Ԫ��ԭ���γɵĵ��ʣ�A��C��E��Ϊ���������EΪSiO2����D����Ԫ��ԭ�ӵ���������B��2����Aת��ΪB��Bת��ΪC������Ӧ�������û���Ӧ����д��A�ĵ���ʽ��______________��Aת��ΪB�Ļ�ѧ����ʽΪ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����з�Ӧ����������ȡ�����ࡣ
��2Sb2S3+6Fe+3O2![]() Sb4O6+6FeS ��Sb4O6+6C
Sb4O6+6FeS ��Sb4O6+6C![]() 4Sb+6CO��
4Sb+6CO��
���ڷ�Ӧ��������˵������ȷ������ ��
A. ��Ӧ���б�������Ԫ����Sb��Fe
B. ��Ӧ����ÿ����2molFeSʱ��ת��4mol����
C. ��Ӧ��˵��������C�Ļ�ԭ�Ա�Sbǿ
D. ÿ����2molSbʱ����Ӧ���뷴Ӧ���л�ԭ�������ʵ���֮��Ϊ1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ�����ͼװ����ȡ��ϩ����Ӧԭ��Ϊ CH3CH2OH![]() CH2�TCH2��+H2O��ij��ѧѧϰС��ͨ����ԭ����ȡ��ϩ���������ʽ�����֤��
CH2�TCH2��+H2O��ij��ѧѧϰС��ͨ����ԭ����ȡ��ϩ���������ʽ�����֤��

��1������ȡʱ��������Ҫ����ƿ�м������Ƭ��Ŀ����____________��
��2��Ҫ�������ɵ����ʣ�Ӧ�����ȼ���________����ѡ�õ�ҩƷΪ_______________��
��3����ȡʱ���ؼ�Ҫ���ƺ��¶ȡ�
���¶ȹ��߶���������Ӧ��ʹ�����Ҵ���Ũ���ᷴӦ���ɶ�����������̼��ˮ������̿�ڡ�Ϊ�˳�ȥ��ˮ��������������壬����װ�������Լ���ϴ��ƿ����ϴ������Ӧѡ�õ��Լ���______��
A.����KMnO4��Һ B.Ũ���� C.NaOH��Һ D.��ˮ
����ȡʱ�¶ȹ��ͣ���1400Cʱ��Ҫ�������Ӽ�ȡ����Ӧ�������ѣ�CH3CH2OCH2CH3��,��д���䷴Ӧ����ʽ___________��
��4�����������������ͨ�����Ը��������Һ�����Ը��������Һ��ɫ�������µ���ɫ��ζ���������������ɲ������ѭ����������Ӧ�����ӷ���ʽΪ_____��Ȼ������ͨ����ˮ����ˮ��ɫ��������״�������ɡ�
��5����ϩ��ij��ͬϵ�����Է�������Ϊ��ϩ��3������ͬ���칹������Ϊ_____�������������ӳɣ��õ�������������������ȡ����Ӧ����һ��ȡ������Ϊ���ֵ������Ľṹ��ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС���Mg��Al�����ʽ��������е�ʵ�鼰�о���

��1����þ������ƬΪ�缫��ϡNaOH��ҺΪ����ʹ��ɵ�ԭ��أ���ͼ1��ʾ��ʱ���֣��տ�ʼʱ��������ָ������ƫת��þ���������������ܿ�ָ��������ƫת��þ�������м����������ݲ�����
�ٿ�ʼ�Σ����������ķ�Ӧ��________��
�����Σ���Ƭ�����ĵ缫��Ӧʽ��_______����þ�缫�����ĵ缫��Ӧʽ��________��
��2�����о��ⶨ��þ�벻ͬŨ�ȵ����ᷴӦ�������������ĺ�����HNO3Ũ�ȱ仯������ͼ2��ʾ����Һ�еIJ�����Mg��NO3��2��NH4NO3��H2O��96 mg Mg��1 L 4molL��1��HNO3����ȫ�ܽ⣬�����ռ���22.4mL����״���£����壨���Է�Ӧ������HNO3Ũ�ȵı仯�����÷�Ӧ�Ļ�ѧ����ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Mo)��һ������ϡ�н������ҹ����ⴢ��������ڶ����⼰��Ͻ���ұ��ũҵ�������������������ȷ������Ź㷺��Ӧ�á�
��1��Mo�ɱ�������������������MoOF4��MoO2F2���ʵ�����Ϊ1��1��������з���ʽ��____Mo+____HF+____HNO3=____ MoO2F2+____ MoOF4+____NO2��+____ _________
��2����֪����2Mo(s)+3O2(g)=2MoO3(s) ��H1
��MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ��H2
��2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ��H3
����H3 =_________���ú���H1����H2�Ĵ���ʽ��ʾ�����ڷ�Ӧ��������0.2mol MoS2�μӷ�Ӧ����ת�Ƶ���_______________mol��
��3���ܱ���������Na2CO3(S)���������ͬʱ��һ������������ԭ�����(MoS2)��ԭ������MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ��H��ʵ����ƽ��ʱ���йر仯������ͼ��ʾ��
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ��H��ʵ����ƽ��ʱ���йر仯������ͼ��ʾ��

����ͼ��֪���÷�Ӧ����H__0������>������<������P2__________0.1MPa������>������<������
�����������Ӧ�����������ܱ������д�ƽ�⣬����˵���������______��ѡ��������
A.v��(H2)=v��(H2O)
B.�ټ���MoS2����H2ת��������
C.������������ܶȲ���ʱ��һ����ƽ��״̬
D.������ѹǿ����ʱ��һ����ƽ��״̬
����ͼ��֪M��ʱ������ƽ��ת����Ϊ____������������0.1%����
��ƽ�ⳣ������ƽ���ѹ����ƽ��Ũ�ȼ��㣬�����ѹ=������ѹ�����ʵ�����������ͼ��M���ƽ�ⳣ��Kp=______(MPa)2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com