
����Ŀ��A��B��C��D��E��F�������ʵ�ת����ϵ��ͼ��ʾ����Ӧ�����Ͳ��ֲ���δ����� 
��1����AΪ�����ڽ������ʣ�DΪ�����ڷǽ������ʣ�������Ԫ�ص�ԭ������A��D��2��������Ԫ�ص�ԭ������������D��A��2����F��Ũ��Һ��A��D��Ӧ���к���ɫ�������ɣ�������C��������ѧ������Ϊ �� ��Ӧ�ܵĻ�ѧ����ʽΪ��
��2����A�dz����Ľ������ʣ�D��F����̬���ʣ��ҷ�Ӧ����ˮ��Һ�н��У���Ӧ��Ҳ��ˮ��Һ�н��У������ӷ���ʽ��������E�����������ӵIJ��������� �� A������1mol/Lϡ����160mLǡ�÷�Ӧ���������A����g��
��3����A��D��F���Ƕ����ڷǽ���Ԫ�ص��ʣ���A��D����Ԫ��ͬ���壬A��F����Ԫ��ͬ���ڣ���Ӧ�ٵĻ�ѧ����ʽΪ ��
���𰸡�
��1�����Ӽ���C+4HNO3��Ũ�� ![]() CO2��+4NO2��+2H2O
CO2��+4NO2��+2H2O
��2��Cl2+2Fe2+=2Cl��+2Fe3+������KSCN��Һ���μӺ���Һ��Ѫ��ɫ��3.36
��3��2C+SiO2 ![]() Si+2CO��
Si+2CO��
���������⣺��1����AΪ�����ڽ������ʣ�DΪ�����ڷǽ������ʣ�������Ԫ�ص�ԭ������A��D��2������Aԭ��������ż��������Ԫ�ص�ԭ������������D��A��2����A����������С��4��Ϊż����Dλ�ڵڶ����ڡ�Aλ�ڵ������ڣ���A��Mg��D��CԪ�أ�F��Ũ��Һ��A��D��Ӧ���к���ɫ�������ɣ�����ɫ������NO2 �� ��F��HNO3 �� C��HNO3Ũ��Һ��Ӧ����CO2��NO2��H2O��B�ܺ�Mg��Ӧ����̼���ʣ���B��CO2 �� C��MgO��C�к������Ӽ���MgO�����ᷴӦ����Mg��NO3��2��H2O��Mg�����ᷴӦ����Mg��NO3��2 �� ��E��Mg��NO3��2��ͨ�����Ϸ���֪��B��CO2��F��HNO3 �� �ڼ��������£�̼��Ũ���ᷢ��������ԭ��Ӧ���ɶ�����̼������������ˮ����Ӧ�ܵĻ�ѧ����ʽΪC+4HNO3��Ũ�� ![]() CO2��+4NO2��+2H2O�����Դ��ǣ����Ӽ���C+4HNO3��Ũ��
CO2��+4NO2��+2H2O�����Դ��ǣ����Ӽ���C+4HNO3��Ũ�� ![]() CO2��+4NO2��+2H2O��
CO2��+4NO2��+2H2O��
��2.����A�dz����Ľ����ĵ��ʣ�D��F����̬���ʣ�A��Fe����Ӧ����ˮ��Һ�н��У���Ӧ��Ҳ��ˮ��Һ�н��У���B���ᣬC���Σ�D��F��Ӧ�����ᣬ�κ����嵥��F��Ӧ����E��Fe�����嵥��ֱ�ӷ�Ӧ����E����F��Cl2��E��FeCl3��C��FeCl2��B��HCl��D��H2 �� �Ȼ��������������������Ȼ�������Ӧ�ڣ���ˮ��Һ�н��У������ӷ���ʽΪCl2+2Fe2+=2Cl��+2Fe3+ �� ����FeCl3�������ӵIJ����������ǵ���KSCN��Һ���μӺ���Һ��Ѫ��ɫ��Fe��1mol/Lϡ����160mLǡ�÷�Ӧ����������������ʱ����������࣬������Ϊ ![]() g=3.36g�����Դ��ǣ�Cl2+2Fe2+=2Cl��+2Fe3+������KSCN��Һ���μӺ���Һ��Ѫ��ɫ��3.36��
g=3.36g�����Դ��ǣ�Cl2+2Fe2+=2Cl��+2Fe3+������KSCN��Һ���μӺ���Һ��Ѫ��ɫ��3.36��
��3.��A��D��F���Ƕ����ڷǽ���Ԫ�ص��ʣ���A��D����Ԫ��ͬ���壬A��F����Ԫ��ͬ���ڣ���AΪC��DΪSi��FΪO��BΪSiO2 �� ��Ӧ��ΪC���������ķ�Ӧ���÷�ӦΪ2C+SiO2 ![]() Si+2CO�������Դ��ǣ�2C+SiO2
Si+2CO�������Դ��ǣ�2C+SiO2 ![]() Si+2CO����
Si+2CO����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL 0.1 mol/L��K2CO3��Һ����μ���0.1 mol/L��ϡ����40 mL,��Һ�к�̼Ԫ�صĸ�����(CO2���ݳ�δ����)�����ʵ�����������ҺpH�仯���������ͼ��ʾ������˵����ȷ����
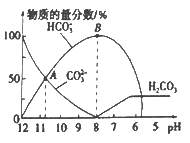
A. ����ϡ����ļ��룬��Һ��![]() ���ֲ���
���ֲ���
B. ����A����㣬Ka2 (H2CO3)��������Ϊ10-3
C. B ����������Һ�У�c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. ��pHԼΪ8ʱ����Һ�п�ʼ�ų�CO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ�ǣ� ��
A.Fe2O3���ڹ����������Һ�У�Fe2O3+6H++2I��=2Fe2++I2+3H2O
B.Ca��HCO3��2��Һ�����NaOH��Һ��Ӧ��HCO ![]() +Ca2++OH���TCaCO3��+H2O
+Ca2++OH���TCaCO3��+H2O
C.��Ũ�����ữ��KMnO4��Һ��H2O2��Ӧ��֤��H2O2���л�ԭ�ԣ�2MnO ![]() +6H++5H2O2=2Mn2++5O2��+8H2O
+6H++5H2O2=2Mn2++5O2��+8H2O
D.AlCl3��Һ�������Ũ��ˮ��Al3++4NH3?H2O=AlO2��+4NH4++2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ʵ���������������ơ�����������ۺ����ۻ�������ת����ϵ��ͼ��ʾ�� 
����˵������ȷ���ǣ� ��
A.xΪNaOH��Һ��yΪ����
B.a��b�����ķ�ӦΪ��AlO2��+H++H2O�TAl��OH��3��
C.b��c��Al�ķ�Ӧ�����ֱ�Ϊ�����ȡ����
D.a��b��c��������������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ʯȼ�ϵļӹ�˵����ȷ���ǣ�������
A.ʯ���ѻ���Ҫ�õ���ϩ
B.ʯ�ͷ����ǻ�ѧ�仯���ɵõ����͡�ú��
C.ú������Ҫ�õ���̿��ú���͡��ְ�ˮ�ͽ�¯��
D.ú��ú���������仯���Ǹ�Ч����������ú����Ҫ;��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ĺ��ɣ����뽨���ڲ����������ӽṹ�Ļ����ϣ����й������ϸ���ķ��ӵ�˵������ȷ���ǣ� ��
A. ϸ���еĴ���ӻ��������̼��Ϊ�Ǽܣ����̼��ϸ���ں�������Ԫ��
B. ϸ���е�֬�ʷ��ӵ����ĺ���ԶԶ�������࣬����ĺ�������
C. ��С��ϸ���ڼ�ij������ķ���ʽΪC12H22O11��������������
D. �������ڵ��������ӣ����뱣��һ�������������ά��ϸ�������ƽ��dz���Ҫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CH3CH2CH2CH2OH![]() CH3CH2CH2CHO��������ͼװ�����������ϳ�����ȩ��������������
CH3CH2CH2CHO��������ͼװ�����������ϳ�����ȩ��������������
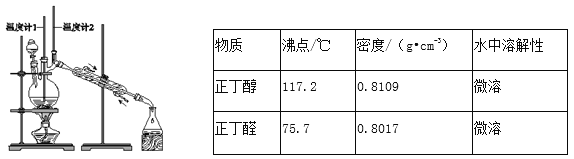
����˵���У�����ȷ����
A. Ϊ��ֹ�����һ��������Ӧ���ữ��Na2Cr2O7��Һ ��μ�����������
B. ���¶ȼ�1ʾ��Ϊ90��95�棬�¶ȼ�2ʾ����76������ʱ���ռ�����
C. ��Ӧ������������ﵹ���Һ©���У���ȥˮ�㣬������ȩ�ӷ�Һ©���Ͽڵ���
D. ���õĴ�����ȩ�м������������ƣ����������Ƿ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Q��R��T��M��W���ֶ�����Ԫ�������ڱ��е����λ����ͼ��ʾ,����M��ԭ��������R��ԭ��������2��������˵����ȷ���ǡ�(����)

A. ԭ�Ӱ뾶��С˳��Ϊr(Q)>r(R)>r(T)>r(M)>r(W)
B. Q��W�ĵ������ӵĺ�����������
C. ����Ԫ�ؾ����γ��⻯��
D. W���⻯��ˮ��Һ������ǿ,˵��W�ķǽ�����������Ԫ������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£������������Ϊ0.5L���ܱ������з�����Ӧ��CO(g)+Cl2(g)![]() COCl2(g)��������������5 minʱ����ƽ�⡣����˵������ȷ����
COCl2(g)��������������5 minʱ����ƽ�⡣����˵������ȷ����
������� | �¶�/�� | ��ʼ���ʵ���/mol | ƽ�����ʵ���/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
�� | 500 | 1.0 | 1.0 | 0 | 0.8 |
�� | 500 | 1.0 | a | 0 | 0.5 |
�� | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
A. ��������ǰ5 min��ƽ����Ӧ����v(CO)��0.32 mol��L-1��min-1
B. �÷�Ӧ����ӦΪ���ȷ�Ӧ
C. ����������ʼʱCl2�����ʵ���Ϊ0.55 mol
D. ����ʼʱ�����������CO 0.8 mol��Cl20.8 mol���ﵽƽ��ʱCOת���ʴ���80%
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com