
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶 | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| D. | 酸式滴定管尖嘴部分开始实验时有气泡,滴定后无气泡 |
分析 根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A.酸碱中和滴定时,用待测液润洗锥形瓶,溶质的物质的量偏大,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$可知c(待测)偏大,故A错误;
B.酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液,标准溶液被稀释,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$可知c(待测)偏大,故B错误;
C.滴定终点读数时,俯视滴定管的刻度,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$可知c(待测)偏小,故C正确;
D.酸式滴定管尖嘴部分开始实验时有气泡,滴定后无气泡,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$可知c(待测)偏大,故D错误.
故选C.
点评 本题考查了中和滴定中的误差分析,注意锥形瓶不能润洗,滴定管必须润洗,本题难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | HF、H2O的沸点比HCl、H2S的沸点高很多 | |
| B. | 正戊烷的沸点比新戊烷的沸点高 | |
| C. | 邻羟基苯甲酸的沸点比对羟基苯甲酸的低 | |
| D. | Na2O的熔点比MgO的熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Li、Na、K密度较小,应保存在煤油中 | |
| B. | CuO、Na2O、Mn2O7属于碱性氧化物 | |
| C. | SO2具有漂白性,可使溴水褪色 | |
| D. | 往Fe(OH)3胶体中逐滴加入稀H2SO4会产生沉淀而后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

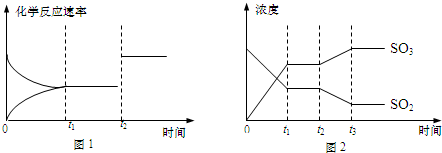
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
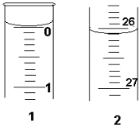 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
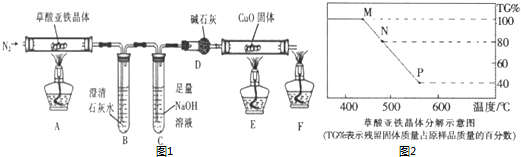
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
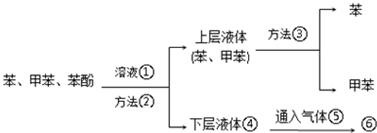
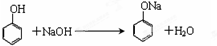 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
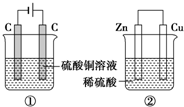 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com