
【题目】由U形管、质量为mg的铁棒、质量为mg的碳棒和1L0.2mol·L-1CuCl2溶液组成如图所示装置,下列说法不正确的是( )
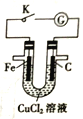
A. 打开K,铁棒上有紫红色物质析出
B. 闭合K,碳棒上有紫红色固体析出
C. 闭合K,碳棒表面发生的电极反应为Cu2++2e-=Cu
D. 闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为9.6g
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】镍具有铁磁性和延展性,能导电和导热。镍单质及其化合物的化学性质与铁相似。
(1)镍易溶于稀的无机酸中,并放出氢气,写出镍与盐酸反应的化学方程式:_____________。
(2)在隔绝空气的条件下,加热NiC2O4使其分解,就能得到暗绿色的氧化亚镍,写出该反应的化学方程式: _____________。
(3)Ni2O3不溶于水,可溶于盐酸并放出氯气,写出该反应的离子方程式: _____________。
(4)氢镍电池是一种碱性可充电电池,污染小,比能量较大。氢镍电池的总反应式是:H2+2NiO(OH) ![]() 2Ni(OH)2。写出放电时的正极反应式: _____________。
2Ni(OH)2。写出放电时的正极反应式: _____________。
(5)纳米材料镍粉(Ni)是一种高性能电极材料,其制备过程如下:
步骤I:取0.2mol/L的硝酸亚镍溶液,调节pH除铁后,加入活性炭过滤。
步骤Ⅱ:向所得滤液中滴加1.5mol/L的NaHCO3溶液使Ni2+完全沉淀,生成:xNiCO3·yNi(OH)2·zH2O。
步骤Ⅲ:将产生的沉淀用大量高纯水清洗并用离心机甩干。
步骤Ⅳ:加入稍过量的肼溶液(N2H4·H2O),使上述沉淀还原完全,将生成的Ni水洗后,再用95%的乙醇浸泡后晾干。为测定xNiCO3·yNi(OH)2·zH2O的组成,进行如下实验:
①准确称取7.54g样品与过量的肼溶液(N2H4·H2O)充分反应,共收集到1.12LN2和CO2的混合气体(已换算成标准状况)。
②另取等质量的样品充分灼烧,冷却后称得残留固体NiO的质量为4.5g。
通过计算确定xNiCO3·yNi(OH)2·zH2O的化学式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S 是一种大气污染物,工业上采取多种方法减少它的排放。
(1)工业上可采取生物脱H2S 方法减少H2S 的排放。生物脱H2S 的原理为:H2S + Fe2(SO4)3= S↓+ 2FeSO4 + H2SO4 4FeSO4 +O2 +2H2SO4 ![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
试回答下列问题:
①硫杆菌存在时,FeSO4被氧化的速率是无菌时5.0×105倍,该菌的作用是_________。
②由下图1和图2 判断使用硫杆菌的最佳条件为_________。若反应温度过高,反应速率下降,其原因是____________。

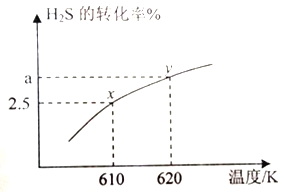
(2) 羰基硫(COS) 常在石化工业中用作在线仪表的校正气、标准气。其制备方法之一是H2S 与COS 在高温下发生反应: H2S(g)+CO2(g)![]() COS(g)+H2O(g) 在610K 时,将0.40mol H2S 与0.10molCO2充入2.5 L 的空钢瓶中,H2S的平衡转化率与温度的关系如图所示:
COS(g)+H2O(g) 在610K 时,将0.40mol H2S 与0.10molCO2充入2.5 L 的空钢瓶中,H2S的平衡转化率与温度的关系如图所示:
①下列说法能表明反应已达平衡状态的是__________。
A.H2S 和CO2的物质的量之比保持不变 B.混合气体的密度保持不变
C.混合气体的平均相对分子质量不再变化D.v逆(H2S)=V正(COS)
②该反应的△H______0.(填“>”“<”或“=”);x点对应温度下反应的平衡常数K=_____(保留两位有效数字)。
③在620K重复试验,若平衡后水的物质的量分数为0.030.则H2S 的转化率a=_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列转化不属于煤或石油的综合利用的是( )
A.将煤干馏制得煤焦油和焦炭
B.在一定条件下将煤与氢气转化为液体燃料
C.将煤变为煤饼作燃料
D.将石油裂解制得乙烯等化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知: SO2(g) +1/2O2(g) ![]() SO3(g) △H=-98 kJ·mol- 1。
SO3(g) △H=-98 kJ·mol- 1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时 v(正)_____v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为____________ 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是(______)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关海水综合利用的说法正确的是
A. 海水中含有钾元素,只需经过物理变化就可以得到钾单质
B. 海水蒸发制海盐的过程中只发生了化学变化
C. 从海水中可以得到NaCl,电解熔融NaCl可制备Na和Cl2
D. 利用潮汐发电是将化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度和体积均相同的一元酸HA与一元碱BOH混合,所得溶液呈酸性。下列判断正确的是
A.HA一定不是弱酸B.BOH一定不是强碱
C.HA一定是强酸D.BOH一定是强碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com