
25 ℃时,水的电离达到平衡:H2O H+ + OH-,下列叙述正确的是( )
H+ + OH-,下列叙述正确的是( )
A.向水中加入少量Na固体,平衡逆向移,c(H+)降低
B.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
C.向水中加入少量硫酸氢钠固体,c(H+)增大,Kw不变动
D.将水加热,Kw增大,pH不变
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源:2016-2017学年福建省高一上期中化学卷(解析版) 题型:计算题
工业电解饱和食盐水产生的氯气制漂白粉,所进行的反应是
① 2NaCl+2H2O Cl2+H2+2NaOH
Cl2+H2+2NaOH
② 2Ca(OH)2(石灰乳)+ 2Cl2 =CaCl2+Ca(ClO)2+2H2O
某厂日产漂白粉(含量80%,主要杂质Ca(OH)2)20吨,已知进行①步反应的转化率90%,进行②步转化率85%。
(1)写出②反应的离子方程式并用双线桥标出电子转移数目
(2)列式计算该厂日消耗精制后的NaCl多少摩尔?(科学计数值,保留小数点后两位)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高二上期中化学卷(解析版) 题型:选择题
某物质的实验式为PtCl4·2NH3,其水溶液不导电。加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是
A.配合物中中心原子的电荷数和配位数均为6
B.该配合物可能是平面正方形结构
C. Cl﹣ 和NH3分子均与Pt4+形成配位
D.该配合物的配体只有NH3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高二上期中化学卷(解析版) 题型:选择题
下列有关氢键的说法正确的是
A.氢键是一种比较弱的化学键
B.HF的稳定性很强,是因为其分子间能形成氢键
C.乙醇分子与水分子之间形成氢键,使乙醇能与水任意比互溶
D.碘化氢的沸点比氯化氢的沸点高是因为碘化氢分子之间存在氢键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省赣州市十四校高二上学期期中化学试卷(解析版) 题型:实验题
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常 见的试剂.
见的试剂.
Ⅰ.测定中和热.
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式 (中和热数值为57.3kJ/mol):
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因可能是 _(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
(1)某学生用已知物质的量浓度的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.实验中不必用到的是
A.酸式滴定管 B.容量瓶 C.锥形瓶 D.铁架台
(2)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____________.当________时,即停止滴定.
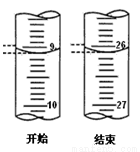
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:已知用c(HCl)=0.10 mol/L的盐酸标定25mL的氢氧化钠溶液,测得c(NaOH)______ ___mol/L
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是___ ___(填序号).
A.锥形瓶用蒸馏水洗净后没有干燥
B.碱式滴定管未用待测液润洗就直接注入待测氢氧化钠溶液
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省赣州市十四校高二上学期期中化学试卷(解析版) 题型:选择题
已知分解1mol KClO3放出热量38.8kJ,在MnO2下加热,KClO3的分解机理为:
①2KClO3+4MnO2 2KCl+2Mn2O7 慢
2KCl+2Mn2O7 慢
②2Mn2O7 4MnO2+3O2 快
4MnO2+3O2 快
下列有关说法不正确的是( )
A.1 mol KClO3所具有的总能量高于1 mol KCl所具有的总能量
B.KClO3分解速率快慢主要取决于反应①
C.1 g KClO3 ,1 g MnO2,0.1 g Mn2O7混合加热,充分反应后MnO2质量为1 g
D.将固体二氧化锰碾碎,可加快KClO3的分解速率
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省辽源市高一上学期期中化学卷(解析版) 题型:实验题

现欲用该浓硫酸配制成1mol/L的稀硫酸。现实验室仅需要这种稀硫酸220mL。试回答下列问题:
(1)用量筒量取该浓硫酸 mL;
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是 ;
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是 ;
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥
F.定容时,俯视容量瓶刻度线
(4)现需配制0.1mol/LNaOH溶液450mL。
①根据计算得知,所需NaOH的质量为 g;
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) ________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省辽源市高一上学期期中化学卷(解析版) 题型:选择题
下列溶液中Cl-浓度最大的是
A.1000mL 2.5mol/L NaCl 溶液 B.300mL 5mol/L KClO3 溶液
C.250mL 1mol/L AlCl3 溶液 D.200mL 2mol/L MgCl2 溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上期中化学卷(解析版) 题型:选择题
标准状况下,1L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏加徳罗常数的值可近似表示为( )
A.22.4(m+n) B.22.4×6.02×1023(m+n) C.22.4 (m+n)/6.02×1023 D.m+n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com