
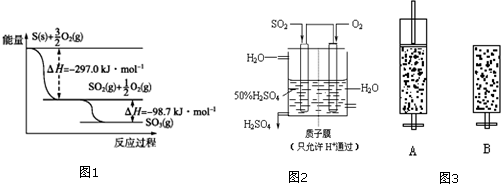
分析 (1)分析图象能量变化,写出化学方程式,标注物质聚集状态和反应焓变写出热化学方程式
(2)根据反应达到平衡过程中放出的热量计算出转化的SO2的物质的量,确定平衡状态,再计算平衡常数;
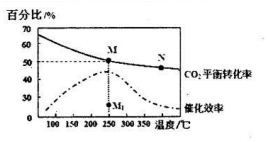
(3)燃料电池能氧气的极为正极,通SO2的极为负极,发生氧化反应,据此书写电极反应式;
(4)①根据化学反应速率越快,到达平衡的时间越短;利用等效平衡来判断平衡移动来解答;
②根据浓度对化学平衡的影响,求出平衡移动后SO3的体积分数;
(5)平衡常数的影响因素为温度,温度不变,在此基础上,增大容器的体积,但O2的浓度不变,相当于恒压恒温条件下,成比例增大反应物的量,由此判断平衡的移动方向.
解答 解:(1)依据图象分析结合反应能量变化,写出化学方程式,标注物质聚集状态和反应热,S和O2生成SO3的热化学方程式为:S(g)+$\frac{3}{2}$O2(g)?SO3(g)△H=(-297.0kJ•mol-1)+(-98.7kJ•mol-1)=-395.7kJ•mol-1,
故答案为:S(g)+$\frac{3}{2}$O2(g)?SO3(g)△H=-395.7kJ•mol-1;
(2)当反应达到平衡时共放出热量196kJ,则变化的SO2的物质的量为$\frac{196kJ}{98kJ/mol}$=2mol,
SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)
起始物质的量(mol) 4 5 0
变化物质的量(mol) 2 1 2
平衡物质的量(mol) 2 4 2
此时平衡常数K=$\frac{c(S{O}_{3})}{c(S{O}_{2})×{c}^{\frac{1}{2}}({O}_{2})}$=$\frac{(\frac{2mol}{10L})}{(\frac{2mol}{10L})×(\frac{4mol}{10L})^{\frac{1}{2}}}$=$\frac{\sqrt{10}}{2}$,
故答案为:$\frac{\sqrt{10}}{2}$;
(3)通SO的极是负极,发生氧化反应,其电极反应为:SO2-2e-+2H2O=SO42-+4H+,故答案为:SO2-2e-+2H2O=SO42-+4H+;
(4)①若A容器保持恒容,两容器建立的平衡等效,而实际上A容器体积减少,压强增大,平衡向正反应方向移动,所以A中SO2的转化率比B大,
故答案为:大;
②向两容器中通入等量的原反应气体,达到平衡后,A中建立的平衡与原平衡等效,所以SO3的体积分数不变,B容器中建立的平衡相当于在原平衡的基础上增大压强,平衡正向移动,B容器中SO3的体积分数增大,
故答案为:不变;增大;
(5)在保证O2浓度不变的情况下,增大容器的体积,此时温度不变,平衡常数不变,相当于将同等平衡状态在恒温恒容条件下回合在一起,平衡不移动,故答案为:不移动.
点评 本题考查化学平衡移动及影响因素,涉及平衡常数的计算、热化学方程式的书写等,本题难度中等,注意等效平衡的理解和应用,掌握基础是解题关键.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C=O | H-H | C=C | C-H | H-O |
| 键能/KJ mol | 803 | 436 | x | 414 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| B. | pH=1的溶液中大量存在Na+、NH4+、SiO32-、I- | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| D. | 0.1mol•L-1NaAlO2溶液中可能大量存在Na+、H+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2AlCl3(熔融)$\frac{\underline{\;电解\;}}{\;}$2Al+3Cl2↑ | |
| B. | 电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+4H++O2↑ | |
| C. | 硫酸氢铵溶液与足量烧碱稀溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
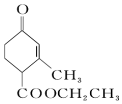 和
和  ,前者不含氧的官能团为(写结构简式)羰基、酯基,后者官能团有(写名称)酯基、羟基;
,前者不含氧的官能团为(写结构简式)羰基、酯基,后者官能团有(写名称)酯基、羟基;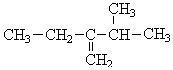 的名称为3-甲基-2-乙基-1-丁烯,
的名称为3-甲基-2-乙基-1-丁烯,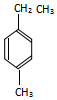 的名称为对甲基乙苯;
的名称为对甲基乙苯;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)?2NO2(g).
在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)?2NO2(g).| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com