
����Ŀ����֪XԪ�ص�ԭ�ӵ�K��L��ĵ�����֮�ͱ�L��M��ĵ�����֮�Ͷ�1�����ӣ�YԪ�ص�ԭ���������������ڲ��������3����ZԪ�غ�����3�����Ӳ㣬�������3�����ӣ�WԪ������ϼ�����ͻ��ϼ۾���ֵ��3������������������е���������Ϊ40%��
��1��Y��W����̬�⻯����ȶ��ԣ��û�ѧʽ��ʾ����
��2���õ���ʽ��ʾX��W�γɻ�����Ĺ���
��3��X�����ڿ����м������ɵĻ�����ĵ���ʽ
��4��X��Z������������Ӧˮ���ﷴӦ�����ӷ���ʽ
��5��Y��Z�γɻ�����Ļ�ѧʽ�� �� ʵ���õ��˻����ﴦ�ڹ�̬��Һ̬ʱ�����磬����ˮ�ܵ��磮�ɴ��жϸû�����������������ӻۣ�
��6��W�ĵͼ���������Y���ʵ�ˮ��Һ��Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1��HCl��H2S
��2��![]()
��3��![]()
��4��Al��OH��3+OH���TAlO2��+2H2O
��5��AlCl3������
��6��SO2+Cl2+2H2O�TH2SO4+2HCl
���������⣺XԪ��ԭ�ӵ�K��L��ĵ�����֮�ͱ�L��M��ĵ�����֮�Ͷ�1�����ӣ�K���е�������2����M���������1������X��NaԪ�أ�YԪ�ص�ԭ���������������ڲ��������3��������������������8���������ڲ��������10������������Ϊ7����Y��ClԪ�أ�ZԪ�غ�����3�����Ӳ㣬�������3�����ӣ���Z��AlԪ�أ�WԪ������ϼ�����ͻ��ϼ۾���ֵ��3����Wλ�ڵ�VIA�壬���������ΪWO3 �� �����������W����������Ϊ40%���� ![]() =40%�����Mr��W��=32����W��SԪ�أ�
=40%�����Mr��W��=32����W��SԪ�أ�
��1.��Y��W����̬�⻯��ֱ���HCl��H2S��ͬһ�����У�Ԫ�ص��⻯���ȶ�������ԭ���������������������Y��W���ȶ���ΪHCl��H2S���ʴ�Ϊ��HCl��H2S��
��2.��ʾX��W�γɻ�����ΪNa2S���õ���ʽ��ʾ�γɹ���Ϊ�� ![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() ����3.��X�����ڿ����м������ɵĻ�������Na2O2 �� ����ʽΪ��
����3.��X�����ڿ����м������ɵĻ�������Na2O2 �� ����ʽΪ�� ![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() ��
��
��4.��X������������ˮ������NaOH��Z������������ˮ������Al��OH��3 �� ��������������������Һ��Ӧ����ƫ�����ƺ�ˮ�����ӷ���ʽΪ��Al��OH��3+OH���TAlO2��+2H2O���ʴ�Ϊ��Al��OH��3+OH���TAlO2��+2H2O��
��5.����Y��Z�γɻ�������AlCl3 �� ��̬��Һ̬�Ȼ��������磬����ˮ�ܵ��磬˵���Ȼ���������״̬��Ϊ���ӣ����ܵ���������ƶ����������ӣ������Ȼ����ǹ��ۻ����ֻ�����ۼ����ʴ�Ϊ��AlCl3�����ۣ�
��6.��W�ĵͼ���������SO2 �� Y���ʵ�ˮ��Һ����ˮ����������������ˮ����������ԭ��Ӧ����������Ȼ��⣬��Ӧ����ʽΪ��SO2+Cl2+2H2O�TH2SO4+2HCl���ʴ�Ϊ��SO2+Cl2+2H2O�TH2SO4+2HCl��
XԪ��ԭ�ӵ�K��L��ĵ�����֮�ͱ�L��M��ĵ�����֮�Ͷ�1�����ӣ�K���е�������2����M���������1������X��NaԪ�أ�YԪ�ص�ԭ���������������ڲ��������3��������������������8���������ڲ��������10������������Ϊ7����Y��ClԪ�أ�ZԪ�غ�����3�����Ӳ㣬�������3�����ӣ���Z��AlԪ�أ�WԪ������ϼ�����ͻ��ϼ۾���ֵ��3����Wλ�ڵ�VIA�壬���������ΪWO3 �� �����������W����������Ϊ40%���� ![]() =40%�����Mr��W��=32����W��SԪ�أ�
=40%�����Mr��W��=32����W��SԪ�أ�


 �Ƹ�С״Ԫ����������ϰ��ϵ�д�
�Ƹ�С״Ԫ����������ϰ��ϵ�д� �ɹ�ѵ���ƻ�ϵ�д�
�ɹ�ѵ���ƻ�ϵ�д� ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д� һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��5���л���ѧ������
������֬�ϳɼ������졢ԭ���á�ͿĤ���ۺ��������ã���Ϳ���úϳ���֬�����������;����Ʒ��֮һ�����ͻ���������֬�ĺϳ�·����ͼ��ʾ��
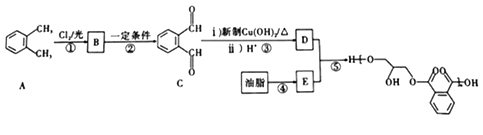
��֪��ͨ������£�����ǻ�����ͬһ��̼ԭ���ϵķ��ӽṹ�Dz��ȶ��ģ������Զ�ʧˮ������̼��˫���Ľṹ�� ���ش��������}��
���ش��������}��
��1��A�Ļ�ѧ������__________��C�й����ŵ�������____________��
��2���ݵķ�Ӧ������________________�� B�ķ���ʽΪ________________��
��3������˵����ȷ����___________������ţ���
a��������A�ĺ˴Ź���������4���
b������B������������ʱ�����Լ���˳�������ǹ�������������Һ����������Һ
c��1molE�������Ľ����Ʒ�Ӧ����33.6LH2����״���£�
��4��C������������ͭ����Һ��Ӧ�Ļ�ѧ����ʽΪ_________________________��
��5����Cu�������������£�F (C8H10O2)��O2��Ӧ����C����F��ͬ���칹���У��������������ķ����廯������_______�֣������������칹)��
a����FeCl3��Һ������ɫ��Ӧ��b���ܷ�����ȥ��Ӧ
��6����֪��RCH2CH=CH2 ![]()
![]() ����2-�����Ϊԭ�ϣ������Լ���ѡ��������Ʊ�E�ĺϳ�·�ߣ�____________________________________________________��
����2-�����Ϊԭ�ϣ������Լ���ѡ��������Ʊ�E�ĺϳ�·�ߣ�____________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.![]() H��
H�� ![]() H��
H�� ![]() H���ֺ��ص����ʲ�ͬ
H���ֺ��ص����ʲ�ͬ
B.16O2��18O2�˴���ͬλ��
C.14N��14C���ֺ��ص���������ͬ����������ͬ
D.�������������Ԫ�ص�����ͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ͬ����������Ӧ���ų������������������ʵ������ٵ���
A. ���� B. ϡ���� C. ����������Һ D. ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�����ʹ��ˮ�����ӳɷ�Ӧ����ɫ���ǣ� ��
A.CH2=CH2B.CH4C.CH3 CH2OHD.CH3 COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ƭ��ϡ���ᷴӦ��ȡH2ʱ,���д�ʩ����ʹ���������������������( )��
A.����
B.����ϡ����,������98%��Ũ����
C.�μ�����Ũ����
D.������Ƭ,��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ò��缫���CuSO4��Һ����ͭ����Ũ�Ƚ���һ��ʱ��ֹͣͨ�磬��ʹCuSO4��Һ�ָ���ԭŨ�ȣ�Ӧ�����������
A. CuO B. H2O C. CuSO4 D. Cu(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I���������(K2FeO4)���к�ǿ�������ԣ����������������й㷺Ӧ�á�
��1��K2FeO4��������Чˮ�����������������÷ֱ���_____��
��2���Ʊ�K2FeO4���Բ���ʪʽ��������������ͼ��
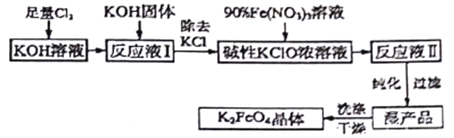
��֪���� �¶Ƚϵ�ʱ��Cl2ͨ��KOH��Һ���ɴ������Σ��¶Ƚϸ�ʱ��Cl2ͨ��KOH��Һ���������Σ��� Fe(NO3)3��Һ��KClO��Һ��ǿ���Ի���������K2FeO4����ش��������⣺
�� ����������Ӧ��_____�������¶Ƚϸ��������¶Ƚϵ�����������½��С�
�� д������K2FeO4�����ӷ���ʽ_________��
��3��ʵ����ģ�ҵ��ⷨ��ȡK2FeO4��װ����ͼ��

�ٴ�װ���е�Դ�ĸ�����______������a������b������
�������ĵ缫��ӦʽΪ______��
II�������£����ȡ0.1mol/LHA��Һ��0.1mol/LNaOH��Һ�������ϣ����Ի�Ϻ���Һ����ı仯������û����Һ��pH=8���Իش��������⣺
��1�������Һ��pH=8��ԭ��_____________�������ӷ���ʽ��ʾ����
��2�������Һ����ˮ�������c(H+)_____������>������<������=����0.1mol/LNaOH��Һ����ˮ�������c(H+)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������AG����ʾ��Һ����ȣ������ʽΪ��AG=lg[![]() ]��298 Kʱ����0��1 mol/L��������Һ�ζ�10 mL 0.1 mol/L ��MOH��Һ���ζ�������ͼ��ʾ������˵����ȷ������ ��
]��298 Kʱ����0��1 mol/L��������Һ�ζ�10 mL 0.1 mol/L ��MOH��Һ���ζ�������ͼ��ʾ������˵����ȷ������ ��
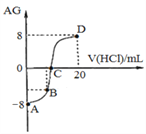
A. �õζ�ʵ�����ѡ���̪��Ϊָʾ��
B. C��ʱ����������Һ���������10 mL
C. �ζ������д�A�㵽D�㣬��Һ��ˮ�ĵ���̶�����С����������
D. ��B������������Һ���Ϊ5mL����������Һ�У�c(M+)+2c(H+)=c(MOH)+2c(OH)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com