
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | 向硝酸银溶液中加入足量的氨水:Ag++2NH3•H2O=Ag(NH3)2++2H2O | |
| D. | 用足量的氨水处理硫酸工业的尾气:SO2+NH3•H2O=NH4++HSO3- |
分析 A.稀盐酸少量,碘离子的还原性大于亚铁离子,碘离子优先被氧化;
B.泡沫灭火器中的药品为NaHCO3和Al2(SO4)3,其中HCO3-和Al3+均可发生水解,且相互促进,产生气体CO2和沉淀Al(OH)3,碳酸氢根离子不能拆开;
C.氨水足量,银离子与一水合氨反应生成银氨络离子;
D.氨水足量,反应生成亚硫酸铵,不是生成亚硫酸氢根离子.
解答 解:A.向Fe(NO3)2和KI混合溶液中加入少量稀盐酸,只有碘离子被氧化,正确的离子方程式为:6I-+8H++2NO3-?2NO↑+4H2O+3I2,故A错误;
B.泡沫灭火器中的药品为NaHCO3和Al2(SO4)3,HCO3-和Al3+均可发生水解,且相互促进,产生气体CO2和沉淀Al(OH)3,离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,故B错误;
C.向硝酸银溶液中加入足量的氨水,生成银氨络离子,反应的离子方程式为:Ag++2NH3•H2O?Ag(NH3)2++2H2O,故C正确;
D.用足量的氨水处理硫酸工业的尾气,反应生成亚硫酸铵,正确的离子方程式为:SO2+2NH3•H2O?2NH4++SO32-,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
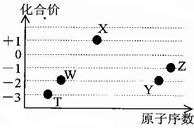 如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )
如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )| A. | X的氢化物具有很强的还原性 | |
| B. | YW2、ZW2、X2W2都能使品红溶液褪色,且褪色原理相同 | |
| C. | Y、Z元素的最高价氧化物对应的水化物都呈酸性,而且酸性:HZO4>H2YO4 | |
| D. | 元素W、T的氢化物的沸点比同主族中相邻的氢化物高,是因为这两种氢化物分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
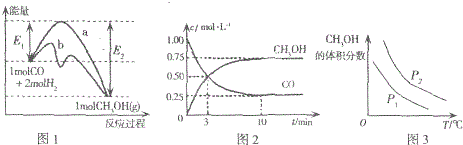
| A. | 图1中曲线b表示使用了催化剂;该反应属于放热反应 | |
| B. | 当压强不同(P1<P2)时,平衡时甲醇的体积分数随温度变化的曲线如图3 | |
| C. | 一定温度下,容器中压强恒定时该反应已达平衡状态 | |
| D. | 该温度下CO(g)+2H2(g)?CH3OH(g)的化学平衡常数为10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | H2CO3 | 水杨酸(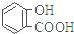 ) ) |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-13 |
| A. | 常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2 CO3 溶液和 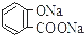 溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. | 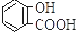 +2NaHCO3→ +2NaHCO3→ +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
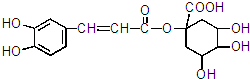 所示:
所示: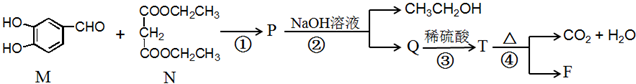

 .
.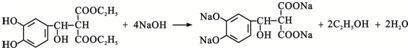 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P既是氧化剂又是还原剂,CuSO4只是还原剂 | |
| B. | 若有11molP参加反应,转移电子的物质的量为60mol | |
| C. | 1molCuSO4可以氧化$\frac{1}{5}$molP | |
| D. | Cu3P既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2固体中含离子总数为3NA | |
| B. | 0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| C. | 40g NaOH溶于1L水中,所得NaOH 溶液的物质的量浓度为1mol/L | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素和油脂都是天然高分子化合物 | |
| B. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 | |
| C. | 乙醇能使酸性高锰酸钾溶液褪色,发生的是氧化反应 | |
| D. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ”,当
”,当查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com