
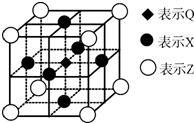
 已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列.
已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列.分析 G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,则G为氢元素;Q原子最外层电子数是内层电子数的两倍,则Q原子有2个电子层,最外层电子数为4,故Q为碳元素;X元素最外层电子数与最内层电子数相同,最外层电子数为2,原子序数大于碳元素,应处于第三周期,故X为Mg元素;T2R的晶体类型是离子晶体,T为+1价、R为-2价,结合原子序数可知,T为Na元素、R为氧元素;Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体,则Y为Si元素;在元素周期表中Z元素位于第11列,则Z为Cu元素,据此解答.
解答 解:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,则G为氢元素;Q原子最外层电子数是内层电子数的两倍,则Q原子有2个电子层,最外层电子数为4,故Q为碳元素;X元素最外层电子数与最内层电子数相同,最外层电子数为2,原子序数大于碳元素,应处于第三周期,故X为Mg元素;T2R的晶体类型是离子晶体,T为+1价、R为-2价,结合原子序数可知,T为Na元素、R为氧元素;Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体,则Y为Si元素;在元素周期表中Z元素位于第11列,则Z为Cu元素.
(1)在元素周期表中Z元素位于第11列,为Cu元素,外围电子排布式是:3d104s1,
故答案为:3d104s1;
(2)同周期自左而右第一电离能呈增大趋势,但Mg原子3s能级容纳两个电子,处于全满稳定状态,电子能量降低,第一电离能高于Al元素,故第一电离能Na<Al<Mg,
故答案为:Na<Al<Mg;
(3)CO2分子中碳原子成2个C=O双键,没有孤电子对,故碳原子采取sp杂化,CO2互为等电子体的一种分子的化学式:N2O(或CS2等),
故答案为:sp;N2O(或CS2等);
(4)O的非金属性强于S,故H2O比H2S稳定,氯化钠属于离子晶体,四氯化碳属于分子晶体,离子晶体的熔点一般高于分子晶体,
故答案为:O的非金属性强于S,故H2O比H2S稳定;氯化钠属于离子晶体,四氯化碳属于分子晶体,离子晶体的熔点一般高于分子晶体;
(5)每个X原子被两个晶胞共用,每个晶胞含有一个Q原子,所以晶体中距每个X原子周围距离最近的Q原子有2个,
故答案为:2.
点评 本题是对物质结构的考查,涉及核外电子排布规律、第一电离能、杂化理论、等电子体、晶体类型与性质、晶胞计算等,题目较为综合,推断元素是解题的关键,难度中等,旨在考查学生对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有8个主族 | B. | 0族原子的最外层电子数均为8 | ||
| C. | ⅠA族的元素全是金属元素 | D. | 短周期是指第1、2、3周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | 氢氧化钠 | C. | 酸性高锰酸钾 | D. | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、OH-、NO3- | B. | Cu2+、HCO3-、NO3- | C. | Mg2+、A13+、SO42- | D. | Mg2+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe 为正极 | B. | Cu 为负极 | ||
| C. | 负极上发生氧化反应 | D. | 正极上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室合成氨的装置如图所示.
实验室合成氨的装置如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com