
| A.金属腐蚀就是金属失去电子被还原的过程 |
| B.将水库中的水闸(钢板)连接一块锌块,可防止水闸被腐蚀 |
| C.由原电池原理知所有的合金都比纯金属更易被腐蚀 |
| D.铜板上的铁铆钉处在潮湿的空气中发生:Fe-3e-===Fe3+,从而形成铁锈,但此过程铜不被腐蚀 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
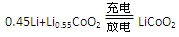 下列说法不正确的是
下列说法不正确的是 | A.放电时电池内部Li+向负极移动 |
| B.该电池不能选用水做溶剂的电解质 |
| C.放电时,正极的电极反应式:0.45Li++Li0。55CoO2+0.45e- |
| D.充电时,外接电源的正极与电池上标注“+”的电极连接 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
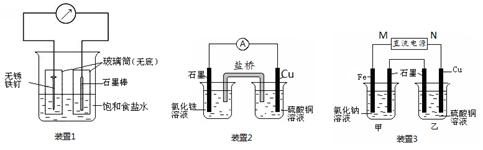
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
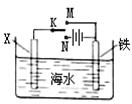
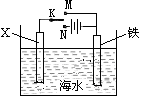
| A.X为锌棒,K置于M,可减缓铁的腐蚀,铁电极上发生的反应为2H++2e-=H2↑ |
| B.X为锌棒,K置于M,外电路电流方向是从X到铁 |
| C.X为碳棒,K置于N,可减缓铁的腐蚀,利用的是外加电流的阴极保护法 |
| D.X为碳棒,K置于N,在X电极周围首先失电子的是Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2H++2e- =H2↑ | B.Fe2++2e- =Fe |
| C.2H2O+O2+4e-=4OH- | D.Fe3++e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
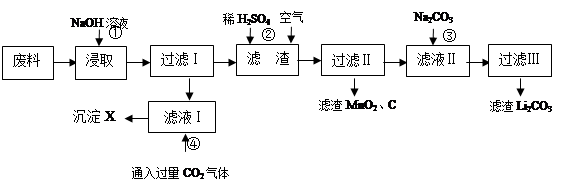
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
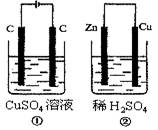
| A.右边电极上生成物质的物质的量:①=② |
| B.相同状态下电极上产生气体的体积:①=② |
| C.溶液的pH变化:①减小,②增大 |
| D.电极反应式①中阴极Cu2++2e-=Cu:②中负极:Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com