
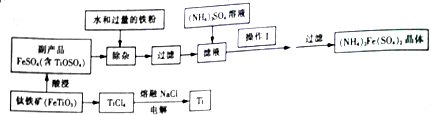
分析 分析流程图和相关信息可知钛铁矿处理得到TiCl4,TiCl4在熔融NaCl作电解质的条件下电解生成Ti,钛铁矿经酸浸得到副产品FeSO4和TiOSO4,加入过量铁粉和水,利用TiO2+水解生成H2TiO3沉淀过滤将TiO2+除去,滤液为硫酸亚铁溶液,向滤液中加入硫酸铵,经蒸发浓缩、冷却结晶和过滤洗涤得到硫酸亚铵晶体;
(1)铁元素在元素周期表中的位置是第四周期第ⅤⅢ族;
(2)TiO2+水解生成H2TiO3和H+,加入过量铁粉的作用是①防止Fe2+氧化为Fe3+,②消耗溶液中H+,促使TiO22+的水解平衡正向进行;
(3)从溶液中获得晶体的操作为蒸发浓缩、冷却结晶和过滤,故操作Ⅰ的实验步骤为蒸发浓缩、冷却结晶;
(4)根据题给信息知TiCl4水解生成TiO2•xH2O沉淀和盐酸,加入大量的水并加热,能促进水解接近完全;
(5)TiCl4在熔融NaCl作电解质的条件下电解生成金属Ti,阳极为阴离子放电,发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,电解过程中有Ti3+、Ti2+的化合物生成,化学方程式为2TiCl4$\frac{\underline{\;通电\;}}{\;}$2TiCl3+Cl2↑,TiCl4$\frac{\underline{\;通电\;}}{\;}$TiCl2+Cl2↑.
解答 解:分析流程图和相关信息可知钛铁矿处理得到TiCl4,TiCl4在熔融NaCl作电解质的条件下电解生成Ti,钛铁矿经酸浸得到副产品FeSO4和TiOSO4,加入过量铁粉和水,利用TiO2+水解生成H2TiO3沉淀过滤将TiO2+除去,滤液为硫酸亚铁溶液,向滤液中加入硫酸铵,经蒸发浓缩、冷却结晶和过滤洗涤得到硫酸亚铵晶体;
(1)铁元素在元素周期表中的位置是第四周期第ⅤⅢ族,
故答案为:第四周期第ⅤⅢ族;
(2)TiO2+水解生成H2TiO3和H+,离子方程式为:TiO2++2H2O?TiO(OH)2+2H+,加入过量铁粉的作用是①防止Fe2+氧化为Fe3+,②消耗溶液中H+,促使TiO22+的水解平衡正向进行,
故答案为:TiO2+2H2O?TiO(OH)2+2H+,防止Fe2+氧化为Fe3+,消耗溶液中H+,促使TiO22+的水解平衡正向移动;
(3)从溶液中获得晶体的操作为蒸发浓缩、冷却结晶和过滤,故操作Ⅰ的实验步骤为蒸发浓缩、冷却结晶,
故答案为:蒸发浓缩、冷却结晶;
(4)根据题给信息知TiCl4水解生成TiO2•xH2O沉淀和盐酸,反应方程式为:TiCl4+(2-x)H2O(过量)?TiO2•xH2O↓+4HCl,加入大量的水并加热,能促进水解接近完全,
故答案为:TiCl4+(2+x)H2O(过量)?TiO2•xH2O↓+4HCl,加入大量的水并加热,能促进水解趋于完全;
(5)TiCl4在熔融NaCl作电解质的条件下电解生成金属Ti,阳极为阴离子放电,发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,电解过程中有Ti3+、Ti2+的化合物生成,化学方程式为2TiCl4$\frac{\underline{\;通电\;}}{\;}$2TiCl3+Cl2↑,TiCl4$\frac{\underline{\;通电\;}}{\;}$TiCl2+Cl2↑,TiCl2$\frac{\underline{\;通电\;}}{\;}$Ti+Cl2↑,
故答案为:2Cl--2e-=Cl2↑,TiCl4$\frac{\underline{\;通电\;}}{\;}$TiCl2+Cl2↑,TiCl2$\frac{\underline{\;通电\;}}{\;}$Ti+Cl2↑.
点评 本题以钛铁矿的综合应用为载体考查了铁元素在周期表的位置,物质的分离、提纯,化学实验基本操作,化学方程式、离子方程式的书写和电解原理的应用,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物X是一种芳香烃 | |
| B. | 有机物X可能不含双键结构 | |
| C. | 有机物X不能与Na2CO3 溶液反应 | |
| D. | 有机物X一定含有碳碳双键或碳碳三键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com