
分析 计算烃的相对分子质量,根据原子守恒确定烃的最简式,进而计算烃的分子式,书写其可能的结构简式.
解答 解:烃燃烧是二氧化碳为$\frac{4.48L}{22.4L/mol}$=0.2mol,水为$\frac{3.6g}{18g/mol}$=0.2mol,
它的相对分子质量是氢气的14倍,则相对分子质量为28,
2.8g烃的物质的量为$\frac{2.8g}{28g/mol}$=0.1mol,
可知1mol烃含有2molC,4molH,分子式为C2H4,结构简式为CH2=CH2,
故答案为:C2H4;CH2=CH2.
点评 本题考查有机物分子式确定,比较基础,注意理解掌握燃烧法利用原子守恒确定有机物分子式.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O的结构式:H-O-H | B. | 乙烯的结构简式为CH2CH2 | ||
| C. | CO2的比例模型: | D. | 丙烯的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
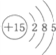 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该原子位于第三周期,ⅤA族 | B. | 该原子位于第五周期,ⅢB族 | ||
| C. | 该原子位于第三周期,ⅤB族 | D. | 该原子位于第五周期,ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. 为原料经过三步反应合成
为原料经过三步反应合成 ,无机原料任选,写出反应的化学方程式:
,无机原料任选,写出反应的化学方程式: +H2$→_{△}^{催化剂}$
+H2$→_{△}^{催化剂}$
 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +NaCl+H2O
+NaCl+H2O +Cl2→
+Cl2→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com