
写出符合要求的化学方程式或离子方程式:
(1)铜和稀硝酸反应的化学方程式 。
(2)实验室用二氧化锰和浓盐酸制备氯气的离子方程式 。
(3)HCOOH和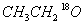 在一定条件下生成酯的化学方程式(标明
在一定条件下生成酯的化学方程式(标明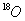 的位置) 。
的位置) 。
(1)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(2分,物质对未配平扣1分,条件不写不扣分,下同)
(2)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (2分)
Mn2++Cl2↑+2H2O (2分)
(3)HCOOH+CH3CH218OH HCO18O CH2CH3+H2O (2分)
HCO18O CH2CH3+H2O (2分)
解析试题分析:(1)硝酸具有氧化性,能把铜氧化,所以铜和稀硝酸反应的化学方程式是3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。
(2)在加热的条件下,二氧化锰能氧化浓盐酸生成氯气,反应的离子方程式是MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(3)在酯化反应中羧酸提供羟基,醇提供氢原子,所以该反应的化学方程式是HCOOH+CH3CH218OH HCO18O CH2CH3+H2O。
HCO18O CH2CH3+H2O。
考点:考查方程式的书写
点评:该题是高考中的常见考点和题型,属于基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的规范答题能力和应试能力。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
[化学选修-物质结构与性质](13分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的氢化物的分子空间构型是 ,其中心原子采取 杂化,属于 (填“极性分子”和“非极性分子”)。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
| 元 素 | M | F | |
| 电离能 (kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是 ;
(4)晶体熔点:DC EC(填“<、=、>”),原因是 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
|
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因 ?
(6)已知某化合反应,在反应过程中只有σ键的断裂与生成,写出符合要求的化学方程式
(写一个)。
查看答案和解析>>
科目:高中化学 来源:2010年福建省师大附中高三模拟考试(理科综合)化学部分 题型:填空题
[化学选修-物质结构与性质](13分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的氢化物的分子空间构型是 ,其中心原子采取 杂化,属于 (填“极性分子”和“非极性分子”)。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
| 元 素 | M | F | |
| 电离能 (kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| | 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省嘉兴市高三上学期基础测试化学试卷(解析版) 题型:填空题
写出符合要求的化学方程式或离子方程式:
(1)铜和稀硝酸反应的化学方程式 。
(2)实验室用二氧化锰和浓盐酸制备氯气的离子方程式 。
(3)HCOOH和 在一定条件下生成酯的化学方程式(标明
在一定条件下生成酯的化学方程式(标明 的位置) 。
的位置) 。
查看答案和解析>>
科目:高中化学 来源:2010年福建省高三模拟考试(理科综合)化学部分 题型:填空题
[化学选修-物质结构与性质](13分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的氢化物的分子空间构型是 ,其中心原子采取 杂化,属于 (填“极性分子”和“非极性分子”)。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
|
元 素 |
M |
F |
|
|
电离能 (kJ·mol-1) |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是 ;
(4)晶体熔点:DC EC(填“<、=、>”),原因是 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
|
|
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
H2S |
187 |
202 |
2.6 |
|
H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因 ?
(6)已知某化合反应,在反应过程中只有σ键的断裂与生成,写出符合要求的化学方程式
(写一个)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com