
| A、O、S、Na的原子半径依次增大 |
| B、LiOH、KOH、CsOH的碱性依次增强 |
| C、HF、NH3、SiH4的稳定性依次增强 |
| D、HCl、HBr、HI的还原性依次减弱 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn为正极,Ag2O为负极 |
| B、放电时,电池负极附近溶液的pH变大 |
| C、放电时,溶液中阴离子向Zn极方向移动 |
| D、放电时,电流由Zn极经外电路流向Ag2O极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最高价氧化物对应水化物的溶解性:b<c |
| B、单质与水反应的剧烈程度:b<c |
| C、相同条件下,氯化物水溶液的pH值:b<c |
| D、可以从b的氯化物水溶液中置换出b. |
查看答案和解析>>
科目:高中化学 来源: 题型:
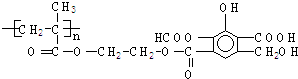
| A、5 mol |
| B、6 mol |
| C、5n mol |
| D、6n mol. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3与FeCl2 |
| B、KHCO3与KOH |
| C、NH4Cl与NaCl |
| D、AlCl3与Al2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑥ | B、④⑤⑥ |
| C、①③④⑥ | D、②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com