
【题目】下列说法正确的是
①6.02×1023个分子的体积约是22.4 L ②0.5 mol H2的体积为11.2 L ③标准状况下,1 mol H2O的体积为22.4 L ④标准状况下,28 g CO与N2的混合气体的体积约为22.4 L ⑤各种气体的气体摩尔体积都约为22.4 L·mol-1 ⑥标准状况下,体积相同的气体所含的分子数相同
A. ①③⑤B. ④⑥C. ③④⑥D. ②④⑥
【答案】B
【解析】
①此物质不一定为气体,若为气体也没有指明是标准状况,则6.02×1023个分子的物质的量为1mol,所占的体积不一定是22.4L,故①错误;
②不一定在标准状况下,则Vm未知,无法确定0.5 mol H2的体积,故②错误;
③标准状况下,水不是气态,则不能根据气体的摩尔体积计算1mol水的体积,故③错误;
④CO与N2的摩尔质量均为28g/mol,标准状况下,28gCO与N2的混合气体的体积约为![]() ×22.4L/mol=22.4L,故④正确;
×22.4L/mol=22.4L,故④正确;
⑤气体摩尔体积与温度、压强有关,则状态未知,不能确定气体的摩尔体积,标准状况下各种气体的气体摩尔体积都约为22.4Lmol-1,故⑤错误;
⑥标准状况下,体积相同的气体,物质的量相同,由n=![]() 可知,分子数相同,故⑥正确;
可知,分子数相同,故⑥正确;
故答案为B。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是( )
A. 浓硫酸可以作CO2 、Cl2气体的干燥剂
B. 浓HNO3与金属反应时,HNO3常被还原为NO2
C. 实验室中浓硝酸要在棕色试剂瓶中密封保存,并放在阴凉处
D. 常温时,可以用铁制容器储存浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中M的分解速率的影响因素进行研究。 在相同温度下,M的物质的量浓度[c(M)]随时间(t)的变化如下图所示。下列说法错误的是

A. 水样酸性越强,M的分解速率越快
B. 水样中添加Cu2+,能加快M的分解速率
C. 由②③得,反应物浓度越大,M的分解速率越快
D. 在0~20 min内,②中M的分解速率为0.015 mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列叙述错误的是( )
A. 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B. 在H2O2+Cl2===2HCl+O2反应中,每生成32 g氧气,则消耗NA个Cl2分子
C. 标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D. 一定温度下,1 L 0.50 mol·L-1 NaCl溶液与2 L 0.25 mol·L-1 Na2CO3溶液含Na+的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W是原子序数递增的五种短周期主族元素,周期数之和为11,其中Y元素最高化合价与最低化合价代数和为2, Z和R可形成R2Z和R2Z2型化合物,R是五种元素中原子半径最大的,Z和W是同族元素,下列说法错误的是
A. 简单离子半径人小顺序为:W>Z>R
B. X2Z2的电子式为:![]()
C. X2Z的沸点比X2W的沸点高
D. Y元素最高价氧化物的水化物浓溶液可以用铝制容器盛装
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用氯化铵熔烧菱锰矿制备高纯碳酸锰的流程如图所示:

已知:①菱锰矿的主要成分是MnCO3,其余为Fe、Ca、Mg、Al等元素。②部分阳离子沉淀时溶液的pH;
离子 | Al3+ | Fe3+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 4.1 | 2.2 | 10.6 | 8.1 | 9.1 |
沉淀完全的pH | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
③焙烧过程中主要反应为MnCO3+2NH4C1![]() MCl2+2NH3↑+CO2↑+H2O
MCl2+2NH3↑+CO2↑+H2O
(1)合1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、c(NH4C1)/c(菱锰矿粉)分别为______、______、______。

(2)对浸出液净化除杂时,需先加入MnO2,作用是______,再调节溶液pH的最大范围为______,将Fe3+和Al3+变为沉淀面除去,然后加人NH4F将Ca2+、Mg2+变为氧化物沉淀除去。
(3)”碳化结品”步骤中,加入碳酸氢铵时反应的离子方程式为______。
(4)上述流程中可循环使用的物质是______(填化学式)。
(5)现用滴定法测定产品中锰的含量。实验步骤:称取4.000g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnO2完全转化为[Mn(PO4)2]3-(其中NO3-转化为NO2-);加入稍过量的硫酸,发生反应NO2-+NH4+=N2↑+2H2O以除去NO2-;加入稀硫酸酸化,再加入60.00mL0.500molL-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-;用5.00mL0.500molL-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为______。
②试样中锰的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法错误的是
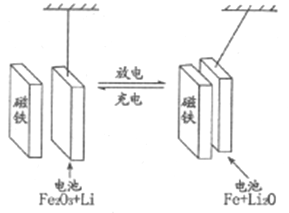
A. 放电时,负极的电极反应式为Li-e-=Li+
B. 放电时,电子通过电解质从Li流向Fe2O3
C. 充电时,Fe做阳极,电池逐渐摆脱磁铁吸引
D. 充电时,阳极的电极反应式为2Fe+3Li2O-6e-= Fe2O3+6Li+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com