
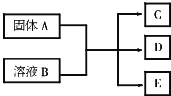
 A、B、C、D、E均为中学化学中的常见物质,它们之间的反应关系如图所示:
A、B、C、D、E均为中学化学中的常见物质,它们之间的反应关系如图所示:分析 (1)若A为Na2CO3,C为温室气体,E为一种常用调味品,C为CO2,E为NaCl,B为HCl;
(2)若A为MnO2,C为黄绿色的有毒气体,B为浓盐酸,C为Cl2,氯气与烧碱反应生成NaCl、NaClO和水;
(3)若C为O2,D、E的焰色反应均显黄色,B、E可以相互转化,E与盐酸反应生成的气体能使澄清石灰水变浑浊,则E为Na2CO3,B为NaHCO3,A为Na2O2,D为NaOH,
只含a mol B的溶液,欲使其变成只含a mol E的溶液,只需要增加钠离子的浓度.
解答 解:(1)若A为Na2CO3,C为温室气体,E为一种常用调味品,C为CO2,E为NaCl,B为HCl,固体A与少量溶液B反应的化学方程式为Na2CO3+HCl=NaCl+NaHCO3,
故答案为:Na2CO3+HCl=NaCl+NaHCO3;
(2)若A为MnO2,C为黄绿色的有毒气体,B为浓盐酸,C为Cl2,氯气与烧碱反应生成NaCl、NaClO和水,C与烧碱的水溶液反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)若C为O2,D、E的焰色反应均显黄色,B、E可以相互转化,E与盐酸反应生成的气体能使澄清石灰水变浑浊,则E为Na2CO3,B为NaHCO3,A为Na2O2,D为NaOH,
若C为O2,D、E的焰色反应均为黄色,D、E中含有Na+,含有Na+的能产生O2的固体为Na2O2,E能与盐酸反应生成的气体能使澄清石灰水变混浊,该气体为CO2,B、E可相互转化,故可知B溶液为NaHCO3溶液,E为Na2CO3溶液,D为NaOH溶液,Na2O2与NaHCO3溶液反应可分解为2Na2O2+2H2O=4NaOH+O2↑、NaHCO3+NaOH=Na2CO3+H2O.
amol NaHCO3→a mol Na2CO3,只要增加a mol Na+,同时用OH-将HCO3-转化为CO32-,所加物质所产生的Na+和OH-的物质的量相等,才能不产生杂质,故X为Na2O或Na2O2,Y为Na或NaOH,故答案为:Na2O或Na2O2;Na;NaOH.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、相互转化为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. |  用托盘天平快速称量一定质量的氢氧化钠固体 | |
| B. |  使用橡皮管能使漏斗中的水顺利流下 | |
| C. |  分离Cl2与KI溶液反应生成的碘 | |
| D. |  分离Cl2与KI溶液反应生成的碘 | |
| E. | 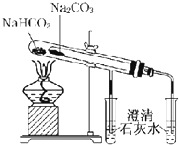 比较Na2CO3和NaHCO3的热稳定性 | |
| F. | 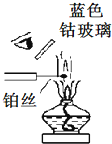 用焰色反应检验钾离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;请写出该反应的一个重要用途:焊接钢轨.
;请写出该反应的一个重要用途:焊接钢轨.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
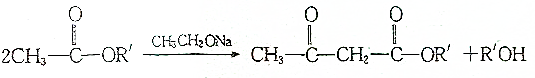
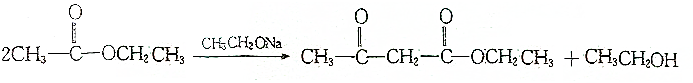 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见下表:
如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见下表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置图 | 所盛试剂 | 实验现象 | |
| 1 | 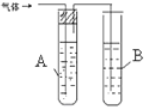 | A是 水 B是 酸性高锰酸钾溶液 | |
| 2 | 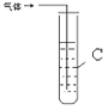 | C是 溴的四氯化碳溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com