
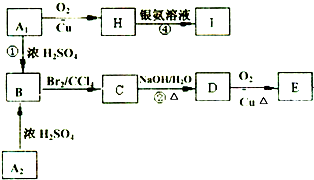
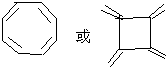
 同分异构体A1和A2分别与浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的52倍,含碳的质量分数为92.3%.在催化剂存在下,1mol B可以和4mol H2发生加成反应.核磁共振氢谱显示,H有5个吸收峰.有关物质之间的转化关系如下:
同分异构体A1和A2分别与浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的52倍,含碳的质量分数为92.3%.在催化剂存在下,1mol B可以和4mol H2发生加成反应.核磁共振氢谱显示,H有5个吸收峰.有关物质之间的转化关系如下:| 104×92.3% |
| 12 |
 ,
, 和溴发生加成反应生成溴代烃C为,
和溴发生加成反应生成溴代烃C为, ,C发生取代反应生成醇D为
,C发生取代反应生成醇D为 ,D被氧化成E为
,D被氧化成E为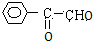 ,A1和A2分别和浓H2SO4在一定温度下共热都只生成烃B,则A1和A2中都含有醇羟基,A1能被氧化生成醛,则A1中醇羟基位于边上,所以A1的结构简式为
,A1和A2分别和浓H2SO4在一定温度下共热都只生成烃B,则A1和A2中都含有醇羟基,A1能被氧化生成醛,则A1中醇羟基位于边上,所以A1的结构简式为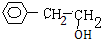 ,醇能被氧化生成H为
,醇能被氧化生成H为 ,H再与银氨溶液反应生成I为
,H再与银氨溶液反应生成I为 ,A2的结构简式为
,A2的结构简式为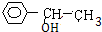 ,据此答题.
,据此答题.| 104×92.3% |
| 12 |
 ,
, 和溴发生加成反应生成溴代烃C为,
和溴发生加成反应生成溴代烃C为, ,C发生取代反应生成醇D为
,C发生取代反应生成醇D为 ,D被氧化成E为
,D被氧化成E为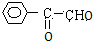 ,A1和A2分别和浓H2SO4在一定温度下共热都只生成烃B,则A1和A2中都含有醇羟基,A1能被氧化生成醛,则A1中醇羟基位于边上,所以A1的结构简式为
,A1和A2分别和浓H2SO4在一定温度下共热都只生成烃B,则A1和A2中都含有醇羟基,A1能被氧化生成醛,则A1中醇羟基位于边上,所以A1的结构简式为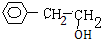 ,醇能被氧化生成H为
,醇能被氧化生成H为 ,H再与银氨溶液反应生成I为
,H再与银氨溶液反应生成I为 ,A2的结构简式为
,A2的结构简式为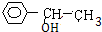 ,
, ,H中官能团为醛基,
,H中官能团为醛基,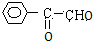 ,故答案为:
,故答案为: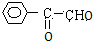 ;
;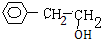 +O2
+O2| Cu |
 +2H2O,
+2H2O,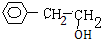 +O2
+O2| Cu |
 +2H2O;
+2H2O; +Br2→
+Br2→ ,
, +Br2→
+Br2→ ;
; ,
, .
.


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L H2O含有的分子数为1 NA |
| B、常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02 NA |
| C、通常状况下,1 NA 个CO2分子占有的体积为22.4 L |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冰和干冰既是纯净物又是化合物 |
| B、CuSO4?5H2O属于纯净物 |
| C、纯碱和熟石灰都是碱 |
| D、豆浆和雾都是胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试剂X |
2- 4 |
| Ⅰ加盐酸ⅡBaCl2溶液 |
| Ⅲ系列操作 |
| 称量 |
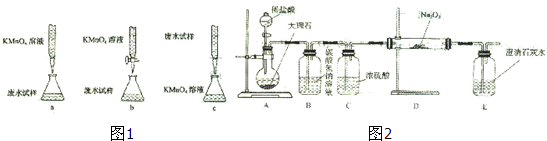
查看答案和解析>>
科目:高中化学 来源: 题型:
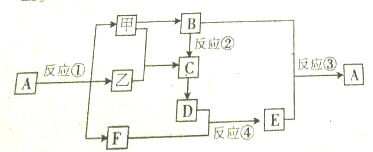
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海水中含有溴元素,需经过化学变化才可以得到溴单质 | ||||||||
| B、无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能 | ||||||||
| C、从海水中可以得到NaCl,电解熔融NaCl可制备金属钠 | ||||||||
D、从海水中提取镁可以采用下列方法:海水海水
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com