
【题目】某溶液中含有以下离子中的若干种:K+、Cl-、NH、Mg2+、CO![]() 、Ba2+、SO
、Ba2+、SO![]() 。现取3份该溶液各100 mL分别进行如下实验:
。现取3份该溶液各100 mL分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
① | 加AgNO3溶液 | 有白色沉淀生成 |
② | 加足量NaOH溶液并加热 | 收集到气体,在标准状况下体积为2.24 L |
③ | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为12.54 g,第二次称量读数为4.66g |
试回答下列问题:
(1)根据实验①对Cl-是否存在的判断是_______________(填“一定存在”“一定不存在”或“不能确定”);根据实验①~③判断混合物中一定不存在的离子是___________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol/L) |
__________ | |
(3)试确定K+是否存在 __________ (填“是”或“否”),判断的理是______________________。
【答案】不能确定 Ba2+、Mg2+
阴离子符号 | 物质的量浓度(mol/L) |
SO42 | 0.2 |
CO32 | 0.4 |
是 溶液中肯定存在的离子是NH4+、CO32和SO42,NH4+的物质的量为0.1mol,CO32、SO42的物质的量分别为0.04mol和0.02mol,根据电荷守恒,K+一定存在。
【解析】
(1)、碳酸银、硫酸银、氯化银都是白色沉淀,因此实验①得到白色沉淀无法确定是氯化银,故实验①对Cl是否存在的判断是:不能确定。利用实验②可知含有铵离子,利用实验③可知沉淀一定是碳酸钡和硫酸钡,即溶液中一定含有CO32、SO42,因碳酸钡、碳酸镁、硫酸钡等都是不溶于水的沉淀,故可判知溶液中一定不存在的离子是:Ba2+、Mg2+。所以此题的答案是:不能确定;Ba2+、Mg2+。
(2)、 结合(1)中分析可知溶液中一定含有的阴离子为CO32、SO42,由碳酸钡可溶于盐酸、硫酸钡不溶于盐酸可推知加入盐酸后剩余4.66g固体为BaSO4,利用硫守恒可知溶液中c(SO42)=4.66g ÷ ![]() ÷0.1L=0.2mol/L;12.54 g固体中碳酸钡的质量为12.54g4.66g=7.88g,利用碳守恒可知溶液中c(CO32)=,7.88g÷197g/mol÷0.1L=0.4mol/L,故答案为:
÷0.1L=0.2mol/L;12.54 g固体中碳酸钡的质量为12.54g4.66g=7.88g,利用碳守恒可知溶液中c(CO32)=,7.88g÷197g/mol÷0.1L=0.4mol/L,故答案为:
阴离子符号 | 物质的量浓度(mol/L) |
SO42 | 0.2 |
CO32 | 0.4 |
(3)、溶液中肯定存在的离子是NH4+、CO32和SO42,经计算,NH4+的物质的量为2.24L÷22.4L/mol=0.1mol,则此时NH4+所带的正电荷的物质的量是0.1mol;利用(2)中分析、计算可知CO32、SO42的物质的量分别为0.04mol和0.02mol,则CO32、SO42所带的负电荷的物质的量为(0.04+0.02)×2=0.12mol,所以根据电荷守恒可知溶液中一定存在K+。故答案为:是;溶液中肯定存在的离子是NH4+、CO32和SO42,NH4+的物质的量为0.1mol,CO32、SO42的物质的量分别为0.04mol和0.02mol,根据电荷守恒,K+一定存在。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】以下为中学化学中常见的物质:①Cu; ②1molL﹣1的FeCl3溶液; ③CuCl2溶液;④CO2;⑤H2SO4;⑥酒精;⑦CaCO3;⑧FeSO4;⑨Ba(OH)2
(1)以上物质中属于电解质的是__;属于非电解质的是__.
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入②的溶液,至液体呈透明的红褐色氢氧化铁胶体.则反应的化学方程式为__________________;
(3)将②③⑧混合配制成浓度均为1molL﹣1的混合溶液100mL,加入一定量的铁粉,充分反应后,若铁粉无剩余,且有铜生成.则反应后的溶液中一定含有__阳离子,可能含有__阳离子.
(4)向⑨溶液中逐滴加入稀硫酸,请完成下列问题:
① 写出该反应的离子方程式:______________________________.
② 下列三种情况下,离子方程式与①相同的是__( 填序号).
A.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀
C.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,在一烧杯中盛有100mLH2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央。向该烧杯里缓缓注入Ba(OH)2溶液至恰好完全反应,在此过程中:

(1)烧杯里观察到的实验现象有:
① _______________________________________
② _______________________________________
(2)写出实验过程中反应的离子方程式:_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka(HCOOH)=1.77×104,Ka(CH3COOH)=1.75×105,Kb(NH3·H2O) =1.75×105,下列说法正确的是
A. 相同体积 pH 均为 3 的 HCOOH 和 CH3COOH 溶液,中和 NaOH 的能力相同
B. 0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后:c(HCOO-)+c(OH-)>c(Na+)+c(H+)
C. 均为 0.1 mol·L-1 的 HCOOH 和 NH3·H2O 溶液中水的电离程度相同
D. 0.1 mol·L-1 CH3COOH 溶液中逐滴加入 0.1 mol·L-1 HCl溶液中 不变。
不变。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2 是危害最为严重的大气污染物之一,SO2 的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理 SO2。催化还原 SO2 不仅可以消除 SO2 污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4 可使 SO2 转化为 S,同时生成 CO2 和 H2O。已知 CH4 和 S的燃烧热分别为 890.3 kJ /mol 和 297.2 kJ /mol , CH4 和 SO2 反应的热化学方程式为__________。
(2)用 H2 还原 SO2 生成S 的反应分两步完成,如图 1 所示,该过程中相关物质的物质的量浓度随时间的 变化关系如图 2 所示:

①分析可知X 为______写化学式),0~t1 时间段的温度为_____,0~t1 时间段用SO2 表示的化学反应速率为_____。
②总反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2![]() N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
A. ②④ B. ③④ C. ③⑤ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯乙烯的结构为![]() 。有关该物质的下列说法正确的是( )
。有关该物质的下列说法正确的是( )
A. 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物 6 种
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去乙苯中混有的苯乙烯可以通入等量氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合图回答问题:
(1)学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容如图Ⅰ,现欲用此硫酸配制配制成浓度为0.50molL﹣1的稀硫酸100mL.①所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外还需________。
②所取浓硫酸的体积为________ mL。
(2)写出上述装置中仪器的名称:②________;③________。
(3)若利用装置Ⅱ分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有________,将仪器补充完整后进行的实验操作的名称为________。
(4)实验室常用装置Ⅲ分离碘水中的碘, 进行该操作时,需在碘水中加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:________(填序号)。①常温下为液态 ②I2在其中溶解程度大 ③与水互不相容 ④密度要比水大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列实验描述正确的是
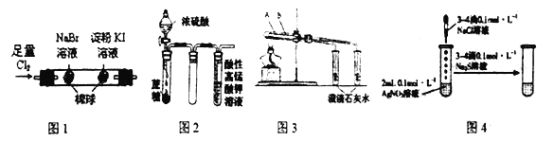
A. 图1:左边棉花变为橙色,右边棉花变为蓝色,还原性:C1-<Br-<I-
B. 图2:酸性KMnO4溶液中出现气泡,但颜色无变化
C. 图3:可用于比较碳酸钠和碳酸氢钠的热稳定性,大试管A中装碳酸钠固体,小试管B中装碳酸氢钠固体
D. 图4:试管中先有白色沉淀、后有黑色沉淀生成,能确定Ksp(AgCl)>ksp(Ag2S)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com