
 依据所学知识回答:
依据所学知识回答:分析 (1)根据 NH3的结构判断PH3 的结构;
(2)①N2H62+是由中性分子 N2H4 结合2个质子形成的,相当于故N2H62+相当于二元酸,碱性溶液中质子与氢氧根结合生成水;
②根据N3-电子数为22分析判断;
③肼分子中每个N原子价层电子对个数是4,根据价层电子对互斥理论判断N原子杂化方式;N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内离子键、配位键和共价键;
④能被该有机物识别即能嵌入空腔形成4个氢键,则要求某分子或离子是正四面体结构且能形成氢键,据此解题.
解答 解:(1)PH3 分子结构和 NH3 相似,都是三角锥型结构,故答案为:三角锥型;
(2)①N2H62+是由中性分子 N2H4 结合2个质子形成的,相当于故N2H62+相当于二元酸,碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O;
故答案为:N2H62++2OH-=N2H4+2H2O;
②含有22个电子的多原子物质有N2O、CO2、CNO-、BeF2、CaH2、C3H4等,故答案为:N2O、CO2;
③肼分子中每个N原子价层电子对个数是4,根据价层电子对互斥理论知N原子杂化方式为sp3,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内离子键、配位键和共价键,不存在范德华力,故答案为:sp3;d;
④要形成氢键,就要掌握形成氢键的条件:一是要有H原子,二是要电负性比较强,半径比较小的原子比如F、O、N等构成的分子间形成的特殊的分子间作用力.符合这样的选项就是C和D,但题中要求形成4个氢键,氢键具有饱和性,这样只有选C.
故选C.
点评 本题考查考查原子结构与性质,涉及化学键的类型和判断等知识,综合考查学生的分析能力和基本概念的综合运用能力,为高考常见题型和高频考点,注意相关基础知识的学习,难度中等.


科目:高中化学 来源: 题型:多选题
 某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是( )
某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是( )| A. | X原子可能为VA族元素 | |
| B. | Y原子一定为IA族元素 | |
| C. | 该分子中,既含极性键,又含氢键 | |
| D. | 从圆球的大小分析,该分子可能为N2F4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同体积,同密度的C2H4和C3H6 | B. | 同温度、同体积和H2和O2 | ||
| C. | 同质量、不同密度的N2和C2H4 | D. | 同压强、同体积的N2和CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.5 mol NH4NO3溶于稀氨水中,溶液呈中性,溶液中NH4+的数目为0.5NA | |
| B. | 将0.2mol NH3充入密闭容器中,在一定条件下加热分解,生成N2的分子数为0.1NA | |
| C. | 足量的铜与50 mL 18 mol/L的浓硫酸在加热条件下反应时,转移的电子数为0.9NA | |
| D. | 标准状况下,8.96L平均相对分子质量为3.5g的H2与D2含有的中子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
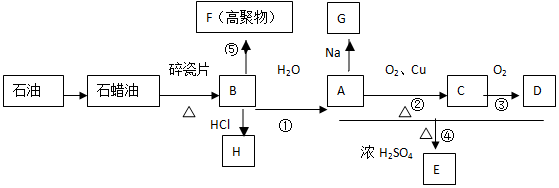
 反应类型:加聚反应
反应类型:加聚反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红的溶液中:Fe2+、Na+、I-、NH4+ | |
| B. | 强碱性溶液中:K+、Na+、ClO-、S2- | |
| C. | 1 mol•L-1 FeCl3溶液中:H+、Na+、SCN-、SO42- | |
| D. | 由H2O电离出的c(H+)=10-11mol/L溶液中:Na+、HCO3-、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 残余固体全部是铜 | |
| B. | 残余固体可能为铁和铜的混合物 | |
| C. | 最后得到的溶液可能含有Fe3+ | |
| D. | 残余固体是铁,溶液中一定不含Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某工厂用电解法处理含有SO2的尾气,其装置如图所示(电极材料均为惰性电极),下列说法不正确的是( )
某工厂用电解法处理含有SO2的尾气,其装置如图所示(电极材料均为惰性电极),下列说法不正确的是( )| A. | 电极a连接的是电源的正极 | |
| B. | 若电路中转移0.03mol e-,则离子交换膜左侧溶液中增加0.03mol离子 | |
| C. | 图中的离子交换膜是阳离子交换膜 | |
| D. | 阴极的电极反应式为2HSO3-+2e-+2H+═S2O42-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com