
常用解热镇痛药—扑热息痛的结构简式为 HO—C6H4—NHCOCH3(C6H4表示苯环)。 对它的叙述有:①能与NaHCO3溶液反应;②能发生水解反应;③不能与浓溴水发生取代反应;④遇三氯化铁溶液显紫色。其中正确的是
A. ①和② B.①和④ C.②和③ D.②和④
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014广东省广州市越秀区高二下学期期末水平调研化学试卷(解析版) 题型:选择题
下列说法正确的是
A.按系统命名法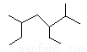 的名称为2-甲基-3,5-二乙基己烷
的名称为2-甲基-3,5-二乙基己烷
B.用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质
C.若两种二肽互为同分异构体,则二者的水解产物一定不相同
D.等质量的甲烷、乙烯、1,3—丁二烯分别充分燃烧,所耗用氧气的量依次增加
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省佛山市高三教学质量检测二理综化学试卷(解析版) 题型:实验题
(16分)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示。
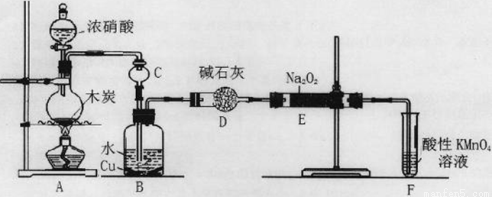
已知:室温下,① 2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2—都能与MnO4—反应生成NO3—和Mn2+,5NO2— + 2MnO4—+ 6H+=5NO3—+ 2Mn2++ 3H2O。
(1)A中观察到的现象__________________________。
(2)装置B中反应的离子方程式有____________________,_____________________。
(3)装置C的作用:____________________,装置F的作用:___________________。
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物________________________。(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有__________________。
A.自来水 B.碘化钾淀粉试液 C.淀粉 D.白糖 E.食醋 F.白酒
(6)充分反应后,某同学设计实验对E中NaNO2的含量进行检测。称取E中固体2g,完全溶解配制成溶液100 ml,取出25 ml溶液用0.100 mol/L酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),消耗KMnO4溶液20ml,求样品中亚硝酸钠的质量分数(保留小数点后1位)(已知:NaNO2摩尔质量69g/mol)
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高二下学期期中化学试卷(解析版) 题型:选择题
下列物质不能使溴水退色而能使酸性高锰酸钾退色的是
A.C2H5OH B.苯酚 C.甲苯 D.乙醛
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高二下学期期中化学试卷(解析版) 题型:选择题
甲、乙、丙三种醇与足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为6:2:3,则甲乙丙三种醇分子里的羟基数之比为
A.1:3:3 B.2:1:3 C.6:3:2 D.1:3:2
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高二下学期期中化学试卷(解析版) 题型:选择题
下列化合物的核磁共振氢谱中出现三组峰的是
A.2,2,3,3一四甲基丁烷 B.2,3,4一三甲基戊烷
C. 3,4一二甲基己烷 D.2,5一二甲基己烷
查看答案和解析>>
科目:高中化学 来源:2013-2014广东清远市市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.毛巾、口罩等个人用品要经常用开水蒸煮,被褥要放在太阳光下直射,其目的都是使病毒蛋白质变性
B.用浓Na2SO4、CuSO4溶液或浓硝酸溶液使蛋清液发生盐析,进而分离、提纯蛋白质
C.蛋白酶是蛋白质,它不仅可以催化蛋白质的水解反应,还可以催化淀粉的水解反应
D.甘氨酸(H2N—CH2—COOH)既有酸性,又有碱性,是最简单的氨基酸
查看答案和解析>>
科目:高中化学 来源:2013-2014广东清远市市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关物质的表达式正确的是
A.乙烯分子的比例模型示意图: B.乙醇的结构简式:CH3CH2OH
B.乙醇的结构简式:CH3CH2OH
C.2-甲基-2-丁烯的键线式 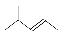 D.1,3-丁二烯的分子式:C4H8
D.1,3-丁二烯的分子式:C4H8
查看答案和解析>>
科目:高中化学 来源:2013-2014广东中山一中、宝安中学等高三七校5月联考化学试卷(解析版) 题型:填空题
(16分)化工工业中常用乙苯脱氢的方法制备苯乙烯。
(1)已知某温度下:
反应①:CO2 (g) +H2 (g)→CO(g) + H2O(g),ΔH= +41.2 kJ/mol
反应②:  (g)→
(g)→ (g)+H2(g), ΔH= +117.6 kJ/mol
(g)+H2(g), ΔH= +117.6 kJ/mol
②的化学反应平衡常数分别为K1、K2。
请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
(2)对于反应①,恒温恒容条件下,向密闭容器中加入2molCO2 和2molH2,当反应达到平衡后,以下说法正确的是 。
A.因为该反应是吸热反应,所以升高温度,正反应速率增大,逆反应速率减小;
B.若继续加入1molCO2、1mol H2,平衡向正反应方向移动;
C.若继续通入1mol CO2则平衡向正反应方向移动,CO2的转化率增大;
D.压缩体积,平衡不移动,反应物和产物的浓度都不变;
(3)温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2;请在下图中画出t1之后的正逆反应曲线,并作出标注。

(4)已知某温度下, Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ksp(Ag2SO4)= ;(两位有效数字)
(5)电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH- = FeO42-+3H2,电解质溶液选用NaOH溶液。该电解池阳极材料是 (写化学式) ;阳极的电极反应式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com