
分析 1)根据五种物质的化学式计算出它们的相对分子质量,可以得到规律:相对分子质量依次增大;
2)根据题意要求,写出质子数相同的两种不同粒子的化学符号.化学符号包括原子符号(用该元素的元素符号表示)、离子符号(在化学符号上带有不同的正负电荷)、分子符号(用该物质的化学式表示)等;
3)(1)二氧化碳属于非金属氧化物;铜属于金属单质;氧气属于单质;水不属于酸;
(2)铜和水、氧气、二氧化碳反应能生成碱式碳酸铜.
解答 解:1)CH4的相对分子质量为16;NH3的相对分子质量为17;HF的相对分子质量为20;HCl的相对分子质量为36.5;故答案为:相对分子质量依次增大;除氢以外元素的质子数依次增大;HCl;10;
2)(1)原子的质子数等于原子序数,单原子离子的质子数等于原子序数,同一种元素的原子和离子:Na与Na+;故答案为:Na与Na+;
(2)分子的质子数等于构成分子的各个原子的质子数的和,不同种分子:H2O与NH3;故答案为:H2O与NH3;
(3)一种原子和一种分子:Ne与H2O;故答案为:Ne与H2O;
(4)两种不同的离子:F与OH-;故答案为:F与OH-;
(5)一种离子和一种分子:O2-与HF,故答案为:O2-与HF;
3)(1)①CaO,Na2O,CO2,CuO中,二氧化碳属于非金属氧化物,其它物质属于金属氧化物;
②S,C,P,Cu中,铜属于金属单质,其它物质属于非金属单质;
③O2,MgCl2,Na2SO4,KNO3中,氧气属于单质,其它物质属于化合物;
④HCl,H2O,H2SO4,HNO3中,水不属于酸,其它物质属于酸.
故填:CO2;Cu;O2;H2O.
(2)铜和氧气、水、二氧化碳反应生成碱式碳酸铜,碱式碳酸铜的化学式是Cu2(OH)2CO3.
故答案为:Cu2(OH)2CO3.
点评 本题涉及物质的分类知识,注意在判断物质是否是单质、化合物、氧化物、酸时,既要判断元素组成,又要判断物质组成,要注意理解基本概念和基本知识.


科目:高中化学 来源: 题型:选择题
| A. | H2O和H2O2中的化学键类型完全相同 | |
| B. | N2的结构式为N-N | |
| C. | 一个D216O分子所含的中子数为10 | |
| D. | 二氧化碳 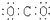 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
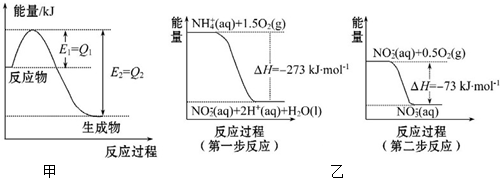
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滤纸上有Ag,Cu,Fe滤液中有Fe2+,Mg2+ | |
| B. | 滤纸上有Ag,滤液中有Fe2+,Cu2+,Mg2+,Ag+ | |
| C. | 滤纸上有Ag,Cu,滤液中有Fe2+,Cu2+,Mg2+ | |
| D. | 滤纸上有Ag,Cu,滤液中有Fe2+,Cu2+,Mg2+,Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 硫酸氢钠溶液中加入足量的烧碱溶液:H++SO42-+OH-═SO42-+H2O | |
| C. | 过氧化钠与水反应:2O2-+2H2O═4OH-+O2↑ | |
| D. | 澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2═Ca2CO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,它们之间的转化关系如图所示((图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).
A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,它们之间的转化关系如图所示((图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | CO32ˉ | C. | CH3COO- | D. | NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com