
【题目】下列物质属于硅酸盐材料的是
A. 碳纤维 B. 石灰石 C. 普通水泥 D. 石英玻璃
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )
A.N2(g)+3H2(g)2NH3(g);△H=2(b﹣a) kJ/mol
B.N2(g)+3H2(g)2NH3(l);△H=2(a﹣b﹣c) kJ/mol
C.![]() N2(g)+
N2(g)+ ![]() H2(g)NH3(l);△H=(b+c﹣a) kJ/mol
H2(g)NH3(l);△H=(b+c﹣a) kJ/mol
D.![]() N2(g)+
N2(g)+ ![]() H2(g)NH3(g);△H=(a+b) kJ/mol
H2(g)NH3(g);△H=(a+b) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料,由A制备聚丙烯酸甲酯(有机玻璃主要成分)和肉桂酸的合成路线(部分反应条件略去)如下图所示:
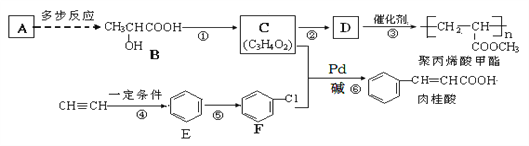
已知:![]() (X为卤原子,R为取代基)
(X为卤原子,R为取代基)![]()
回答下列问题:
(1)B中含氧官能团的名称是____________;反应①的反应条件是__________________;⑥的反应类型是_________。![]()
(2)肉桂酸的化学式为_______________;由C制取D的化学方程式为__________________________________________。
(3)肉桂酸的同分异构体中能同时满足下列条件:①苯环上有两个取代基②能发生银镜反应,③苯环上有两种不同环境的氢。请写出一种符合上述要求物质的结构简式:_______________________________。
(4)请你设计一个由丙烯(CH2=CH-CH3)制备B的合成路线(无机试剂任选)___________。合成路线常用的表示方式为:![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象或化学方程式 | 结论 |
A | 取1mL20%的蔗糖溶液,加入适量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2悬浊液,加热 | 溶液中未出现砖红色沉淀 | 蔗糖未水解 |
B | 将C和SiO2的固体混合物高温加热 | 2C+SiO2 | 非金属性:C>Si |
C | 向盛有2mL0.1mol/L的NaCl溶液的试管中逐滴加入几滴0.1mol/L的AgNO3溶液,充分反应后,再逐滴加入0.1mol/L的KI溶液 | 白色沉淀变为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 向待测液中加入适量的稀NaOH溶液,将|湿润的蓝色石蕊试纸放在试管口 | 湿润的蓝色石蕊试纸未变红 | 在待测液中不存在NH4+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法生产锰时会产生大量的阳极泥,其主要成分为MnO2和Pb,还含有少量其他金属化合物。下图是回收电解锰阳极泥生产MnCO3的工艺流程。

已知:Al(OH)3、Mn(OH)2、MnCO3的Ksp分别为1.0×10-33、1.9×10-13、2.2×10-11。
(l)“还原酸浸”时氧化产物为CO2,发生反应的化学方程式为____。
(2)“还原酸浸”实验中,锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件为 ____ 。

(3)滤液l中的阳离子组成见下表:
组成 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
浓度/(mol·L-1) | 0.85 | 2.4×10-3 | 1.0×10-2 | 2.0×10-3 |
“除杂”时先加MnO2,MnO2的作用为 ___。
再加氨水调节pH使杂质离子沉淀完全,通过计算说明Al3+沉淀完全时Mn2+是否开始沉淀 ___。
(4)“沉锰”时发生反应的离子方程式为 ___。
(5)“沉锰”的关键操作有2点:①将NH4HCO3溶液滴入MnSO4溶液中;②反应终点pH=7。如果颠倒试剂滴加顺序,将MnSO4溶液滴人NH4HCO3,溶液中,或反应终点pH>7可能造成同样的后果,该后果是____;如粜反应终点pH<7,可能的后果是______。
(6)从滤液2中回收得到的副产品的用途为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,图中对此过程的分析正确的是( )
A.图I是加入适当催化剂的变化情况
B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况
D.图Ⅲ是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r的溶液是一种一元强酸,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )
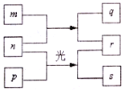
A. 原子半径的大小W<X<Y B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态 D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备.回答下列问题:
(1)正丁烷(C4H10)脱氢制1﹣丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g)△H1
已知:②C4H10(g)+ ![]() O2(g)=C4H8(g)+H2O(g)△H2=﹣119kJmol﹣1
O2(g)=C4H8(g)+H2O(g)△H2=﹣119kJmol﹣1
③H2(g)+ ![]() O2(g)=H2O(g)△H3 =﹣242kJmol﹣1
O2(g)=H2O(g)△H3 =﹣242kJmol﹣1
反应①的△H1为 kJmol﹣1 . 图(a)是反应①平衡转化率与反应温度及压强的关系图,x0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是(填标号).
A.升高温度B.降低温度C.增大压强D.降低压强
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等.图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系.图中曲线呈现先升高后降低的变化趋势,其降低的原因是 .
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物.丁烯产率在590℃之前随温度升高而增大的原因可能是;590℃之后,丁烯产率快速降低的主要原因可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH﹣ ![]() 2CO32﹣+6H2O,则下列说法错误的是( )
2CO32﹣+6H2O,则下列说法错误的是( )
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O
D.充电时每生成1molCH3OH转移6mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com