
 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)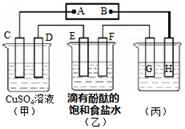


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g) ��H = ��90.8kJ/mol��
CH3OH(g) ��H = ��90.8kJ/mol�� O2(g)=H2O(g) ��H = ��241.8kJ/mol��
O2(g)=H2O(g) ��H = ��241.8kJ/mol�� CH3OH(g)�����б�ʾ�÷�Ӧ�ﵽƽ��״̬�ı�־�� ������ĸ��ţ���
CH3OH(g)�����б�ʾ�÷�Ӧ�ﵽƽ��״̬�ı�־�� ������ĸ��ţ���| A����1��H��H�����ɵ�ͬʱ�� 3��C��H������ |
| B��CO�ٷֺ������ֲ��� |
| C�������л�������ѹǿ���仯 |
| D�������л��������ܶȲ��仯 |
 H2(g)+ CO2(g) ��H��0��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K=1������ʼʱc(CO)=1mol?L-1��c(H2O)=2mol?L��1���Իش��������⣺
H2(g)+ CO2(g) ��H��0��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K=1������ʼʱc(CO)=1mol?L-1��c(H2O)=2mol?L��1���Իش��������⣺
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g) ��H< 0��
CH3OH(g) ��H< 0��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
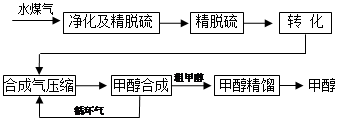
 CO��g��+H2��g�����˷�Ӧ�����ȷ�Ӧ���ٴ˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
CO��g��+H2��g�����˷�Ӧ�����ȷ�Ӧ���ٴ˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��| A������C��s�� | B������H2O��g�� | C�������¶� | D������ѹǿ |
 CO (g)+2H2O (g) +519KJ����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ��
CO (g)+2H2O (g) +519KJ����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ�� CH3OH(g)+181.6kJ��T4���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������м���CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OH(g)+181.6kJ��T4���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������м���CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�| ���� | H2 | CO | CH3OH |
| Ũ��/��mol��L��1�� | 0.2 | 0.1 | 0.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 N2(g)+2H2O(l) ��H="-a" kJ/mol
N2(g)+2H2O(l) ��H="-a" kJ/mol CuO(s)+H2O(l) ��H="b" kJ/mol
CuO(s)+H2O(l) ��H="b" kJ/mol 2Cu2O(s)+O2(g) ��H="c" kJ/mol
2Cu2O(s)+O2(g) ��H="c" kJ/mol Cu2O+H2������������ӦʽΪ�� ��
Cu2O+H2������������ӦʽΪ�� ��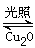 2H2(g)��O2(g) ��H����484 kJ��mol��1
2H2(g)��O2(g) ��H����484 kJ��mol��1| ʱ��/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH=7����Һһ����������Һ |
| B�����Է����еĻ�ѧ��Ӧ����һ���ǡ�H<0����S>0 |
| C�����ȷ�Ӧ����������Ҫ���ϴ���������������ȷ�Ӧһ������Ҫ����������� |
| D��Ksp���������ܵ���ʵ����ʺ��¶��йأ���������Һ�е�����Ũ���й� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ij��Ӧ���ʱ�С���㣬�÷�Ӧһ�����Է����� |
| B����ʪ���pH��ֽ��ϡ������Һ��pHΪ3.52 |
| C����ľ�ң�K2CO3���Ǽطʣ�������ǵ��ʣ������ʩ�ÿ�����߷�Ч |
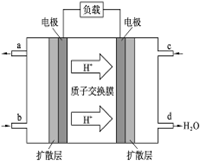
| D��ԭ����ǽ���ѧ��ת��Ϊ���ܵ�װ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
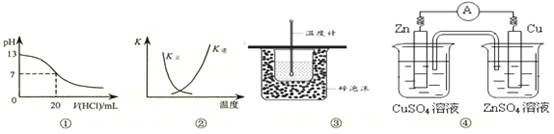
| A��ͼ�ٱ�ʾ25��ʱ����0.1 mol��L��1����ζ�20 mL 0.1 mol��L��1 NaOH��Һ����Һ��pH�����������ı仯 |
B��ͼ�������߱�ʾ��Ӧ2SO2(g) + O2(g)  2SO3(g)����H < 0 �����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯 2SO3(g)����H < 0 �����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯 |
| C��ͼ��װ�����ڲⶨ�к��� |
| D��ͼ��װ�ÿ��Թ���п��ͭ������ͭ��Һԭ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
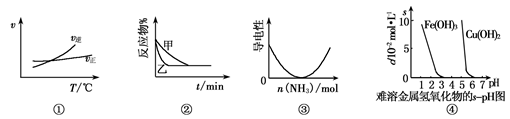
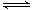 2AB3(g)�Ħ�H>0
2AB3(g)�Ħ�H>0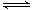 3C(g)��Ӱ�죬��ѹǿ��
3C(g)��Ӱ�죬��ѹǿ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com