
 .
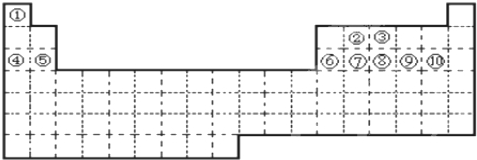
. 分析 根据元素在周期表中的位置知,①~⑩十种元素分别是H、C、N、Na、Mg、Al、Si、P、S、Cl元素,
(1)元素的金属性越强,其单质置换酸中的氢能力越强;元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;元素的金属性越强,其最高价氧化物的水化物碱性越强;显两性的氢氧化物的氢氧化铝,原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;离子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(2)上述十种元素中,金属性最强的元素是Na元素,Na在周期表中的位置是第三周期IA族,该元素的单质在空气中燃烧生成淡黄色固体过氧化钠;
(3)元素①和③形成氨气,N和H原子通过共用电子对形成氨气分子.
解答 解:根据元素在周期表中的位置知,①~⑩十种元素分别是H、C、N、Na、Mg、Al、Si、P、S、Cl元素,
(1)元素的金属性越强,其单质置换酸中的氢能力越强,金属性最强的是Na,所以置换出酸中氢能力最强的是Na;
元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,这几种元素中非金属性最强的是Cl,则其最高价氧化物的水化物酸性最强的是HClO4;
元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性最强的是Na,则碱性最强的是NaOH;
显两性的氢氧化物的Al(OH)3;
原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;离子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以原子半径最大的是Na,离子半径最小的是H+,
故答案为:Na;HClO4;NaOH;Al(OH)3;Na;H+;
(2)上述十种元素中,金属性最强的元素是Na元素,Na在周期表中的位置是第三周期IA族,该元素的单质在空气中燃烧生成淡黄色固体过氧化钠,反应方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,
故答案为:三;IA;2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;
(3)元素①和③形成氨气,N和H原子通过共用电子对形成氨气分子,所以其形成过程为,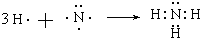 ,故答案为:
,故答案为: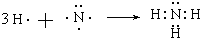 .
.
点评 本题考查元素周期表和元素周期律的综合运用,为高频考点,明确原子结构、元素周期表结构及元素周期律内涵是解本题关键,熟练掌握同一周期、同一主族原子结构和元素性质递变规律,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
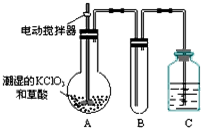 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
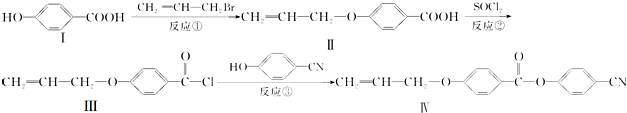
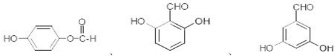 .
. 也可与化合物Ⅲ发生类
也可与化合物Ⅲ发生类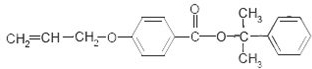 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: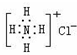 | |
| B. | 氮气的结构式::N≡N: | |
| C. | 氯化氢分子的形成过程可用电子式表示式: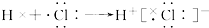 | |
| D. | 重水的化学式为 21H2O(或D2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com