
| A. | 常温常压下,11.2 LCO2所含的原子数为1.5NA | |
| B. | 标准状况下,22.4 L CCl4中所含分子数为NA | |
| C. | 标准状况下,18g水所含原子数为NA | |
| D. | 常温常压下,48 g O2与O3混合物含有的氧原子数为3NA |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、标况下四氯化碳为液体;
C、求出水的物质的量,然后根据水为三原子分子来分析;
D、氧气和臭氧均由氧原子构成.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L二氧化碳的物质的量小于0.5mol,则含有的原子数小于1.5NA个,故A错误;
B、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量和分子数,故B错误;
C、18g水的物质的量为1mol,而水为三原子分子,故1mol水中含3NA个原子,故C错误;
D、氧气和臭氧均由氧原子构成,故48g混合物中含有的氧原子的物质的量为n=$\frac{48g}{16g/mol}$=3mol,故含有3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 5.8g的SCN-中所含电子数为3NA | |
| B. | 0.1mol的CH3CH${\;}_{{2}^{\;}}$18O2H中所含中子数2.3NA | |
| C. | 10gCaCO3和KHCO3的混合物中所含质子数为5NA | |
| D. | 7.9gNH4HCO3固体中所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是难溶于水的酸性氧化物 | |
| B. | 高温下SiO2与碳酸盐反应生成CO2 | |
| C. | SiO2不能与任何酸反应 | |
| D. | 碳化硅(SiC)具有金刚石的结构,硬度很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 次氯酸 | 干冰 |
| B | 冰 | 氨水 | 碳酸钙 | 氢氟酸 | 氨气 |
| C | 氯水 | 漂白粉 | 苛性钾 | 氢硫酸 | 氯化银 |
| D | 胆矾 | 福尔马林 | 氯化钡 | 碳酸 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
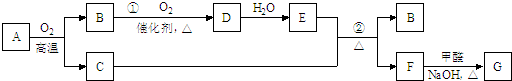
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验 编号 | 温度 /℃ | 平衡常数 /mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | x=2.4 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | 实验1在前6 min的反应速率v(SO2)=0.2 mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com