
 依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:
依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:分析 (1)(2)根据反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”分析,在反应中,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,电解质溶液为AgNO3 ,原电池中,电子从负极经外电路流向正极;
(3)分析反应的化合价变化,可得Li为还原剂,SOCl2为氧化剂,负极材料为Li(还原剂),发生氧化反应,正极SOCl2得电子发生还原反应,据此分析.
解答 解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,Ag为正极,电子从负极经外电路流向正极,即从Cu流向Ag;
故答案为:Cu;Ag;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,Cu被氧化,失电子,Cu为负极,负极反应为Cu-2e═Cu2+;
故答案为:Ag++e-=Ag; Cu-2e-=Cu2+;
(3)分析反应的化合价变化,可得Li为还原剂,SOCl2为氧化剂,负极材料为Li(还原剂),发生氧化反应,其电极反应式为:Li-e-═Li+;
正极发生还原反应,SOCl2在正极得电子生成氯离子、S和SO2,其电极反应式为:2SOCl2+4e-═4Cl-+S+SO2↑,
故答案为:Li-e-═Li+;2SOCl2+4e-═4Cl-+S+SO2↑.
点评 本题考查了原电池原理的分析判断,主要是电极的判断和电极反应式的分析应用,熟练掌握原电池的原理是解题的关键,题目难度中等,侧重于考查学生的应用能力和分析能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
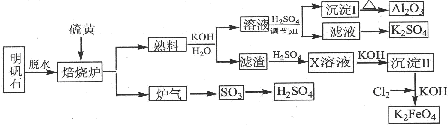
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
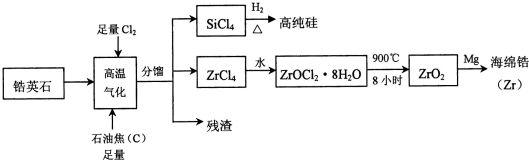
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图装置:用于制取并收集乙酸乙酯 | |
| B. |  如图装置:用于分离两种沸点不同的物质 | |
| C. |  如图装置:收集氨气时,从a口进气b口排气 | |
| D. |  如图装置:可用来快速制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
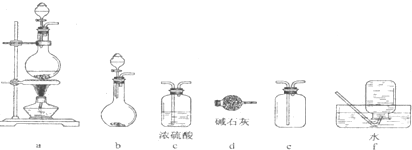
| A. | 加热浓硫酸和乙醇的混合物至170℃制备收集C2H4:连接a→d→f | |
| B. | 制备收集NO2:连接a→c→f | |
| C. | 制备收集Cl2:连接a→d→e | |
| D. | 制备收集NH3:连接b→d→e |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
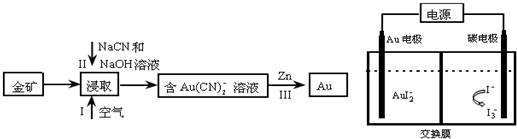
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com