
”¾ĢāÄæ”æ½üÄźĄ“£¬¼Ó”°µā”±Ź³ŃĪ½Ļ¶ąµÄŹ¹ÓĆĮĖµāĖį¼Ų(KIO3)£¬µāĖį¼ŲŌŚ¹¤ŅµÉĻæÉÓƵē½ā·ØÖĘČ”£®ŅŌŹÆÄ«ŗĶ²»ŠāøÖĪŖµē¼«£¬ŅŌKIČÜŅŗĪŖµē½āŅŗ£¬ŌŚŅ»¶ØĢõ¼žĻĀµē½ā£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗKI+3H2O![]() KIO3+3H2”ü£®ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ( )
KIO3+3H2”ü£®ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ( )
A. µē½āŹ±£¬ŹÆÄ«×÷Ņõ¼«£¬²»ŠāøÖ×÷Ńō¼« B. µē½āŹ±Ńō¼«·“Ó¦ŹĒ£ŗI©©6e©+3H2O=IO3©+6H+
C. ČÜŅŗµ÷½ŚÖĮĒæĖįŠŌ£¬¶ŌÉś²śÓŠĄū D. µē½āŗóČÜŅŗµÄpHŌö“ó
”¾“š°ø”æB
”¾½āĪö”æ
ŹŌĢāA.Óɵē½ā·½³ĢŹ½æÉÖŖ£ŗŌŚ·“Ó¦ÖŠI-Ź§Č„µē×Ó±äĪŖIO3-”£Ņņ“Ėµē½āŹ±£¬ŹÆÄ«×÷Ńō¼«£¬²»ŠāøÖ×÷Ņõ¼«”£A“ķĪó;B£®¾Ķ×Ü·“Ó¦·½³ĢŹ½æÉÖŖ£ŗµē½āŹ±£¬Ńō¼«·“Ó¦ŹĒ£ŗI£-6e ØC+ 3H2O = IO3£+ 6H+,BÕżČ·;C£®ČÜŅŗµ÷½ŚÖĮĒæĖįŠŌ£¬»įÓė²»ŠāøÖµē¼«·“Ó¦£¬¶ŌÉś²ś²»Ąū£¬C“ķĪó£»D.µē½ā·“Ó¦·½³ĢŹ½ĪŖ£ŗKI + 3H2O![]() KIO3 + 3H2”ü£¬·“Ó¦²»¶ĻĻūŗÄĖ®£¬µ«KIŹĒĒæĖįĒæ¼īŃĪ£¬ČÜŅŗŹ¼ÖÕ³ŹÖŠŠŌ£¬PH=7£¬D“ķĪó£»Ń”B”£
KIO3 + 3H2”ü£¬·“Ó¦²»¶ĻĻūŗÄĖ®£¬µ«KIŹĒĒæĖįĒæ¼īŃĪ£¬ČÜŅŗŹ¼ÖÕ³ŹÖŠŠŌ£¬PH=7£¬D“ķĪó£»Ń”B”£


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĀķĄ“Ėįōū£ØĖ³-¶”Ļ©¶žĖįōū£©![]() ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬æÉÓĆÓŚŗĻ³Éæɽµ½āµÄøß¾ŪĪļPESŹ÷Ö¬ŅŌ¼°¾ßÓŠæ¹Ö×Įö»īŠŌµÄ»ÆŗĻĪļK”£
ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬æÉÓĆÓŚŗĻ³Éæɽµ½āµÄøß¾ŪĪļPESŹ÷Ö¬ŅŌ¼°¾ßÓŠæ¹Ö×Įö»īŠŌµÄ»ÆŗĻĪļK”£

ŅŃÖŖ£ŗ¢Ł![]()
¢Ś
¢Ū![]() (R1”¢R2”¢R3“ś±ķĢž»ł)
(R1”¢R2”¢R3“ś±ķĢž»ł)
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©CµÄĆū³ĘŹĒ________£¬·“Ó¦¢ŚµÄ·“Ó¦ĄąŠĶŹĒ___________”£
£Ø2£©BµÄĖ³Ź½½į¹¹¼ņŹ½ĪŖ_________£¬FµÄ½į¹¹¼ņŹ½ĪŖ__________”£
£Ø3£©·“Ó¦¢ŁµÄ»Æѧ·½³ĢŹ½ĪŖ_________”£
£Ø4£©CÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬ĘäÖŠÓėC¾ßÓŠĶźČ«ĻąĶ¬µÄ¹ŁÄÜĶÅ£¬ĒŅŗĖ“Ź²ÕńĒāĘ×Ö»ÓŠĮ½øö·åµÄĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½ĪŖ______£Ø²»æ¼ĀĒĮ¢ĢåŅģ¹¹£©”£
£Ø5£©ŅŃÖŖ£ŗ°±»ł(-NH2)ÓėōĒ»łĄąĖĘ£¬Ņ²ÄÜ·¢Éś·“Ó¦¢Ł”£ŌŚÓÉFÖʱøKµÄ¹ż³ĢÖŠ£¬³£»į²śÉśø±²śĪļL”£L·Ö×ÓŹ½ĪŖC16H13NO3£¬ŗ¬ČżøöĮłŌŖ»·£¬ŌņLµÄ½į¹¹¼ņŹ½ĪŖ______”£
£Ø6£©ŅŃÖŖ£ŗĖįōūŌŚĖ®ČÜŅŗÖŠ¼«Ņ×Ė®½ā”£Š“³öÓÉĀķĄ“Ėįōū![]() ŗĻ³É¾ĘŹÆĖį
ŗĻ³É¾ĘŹÆĖį![]() µÄŗĻ³ÉĀ·Ļߣŗ____________________”£
µÄŗĻ³ÉĀ·Ļߣŗ____________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚÓŠ»ś»ÆŗĻĪļµÄĖµ·ØÕżČ·µÄŹĒ
A. ĆŗÖŠŗ¬ÓŠ±½”¢¼×±½ŗĶ“Ö°±Ė®£¬æÉĶعżøÉĮóµĆµ½
B. C4H8Cl2µÄĶ¬·ÖŅģ¹¹ĢåÓŠ7ÖÖ
C. ¼×±½ŗĶŅŅ±½·Ö×ÓÄŚ¹²Ę½ĆęµÄĢ¼Ō×ÓŹż×ī¶ą¾łĪŖ7
D. ÓÉŅŅ“¼ŗĶŅŅĖįÉś³ÉŅŅĖįÖ®õ„ŹōÓŚČ”“ś·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ2.0mol PCl3ŗĶ1.0mol Cl2³äČėĢå»ż²»±äµÄĆܱÕČŻĘ÷ÖŠ£¬ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśĻĀŹö·“Ó¦£ŗPCl3+Cl2![]() PCl5£®“ļĘ½ŗāŹ±£¬PCl5ĪŖ0.40mol£¬Čē¹ū“ĖŹ±ŅĘ×ß1.0mol PCl3ŗĶ0.50mol Cl2£¬ŌŚĻąĶ¬ĪĀ¶ČĻĀŌŁ“ļĘ½ŗāŹ±PCl5µÄĪļÖŹµÄĮæŹĒ£Ø £©
PCl5£®“ļĘ½ŗāŹ±£¬PCl5ĪŖ0.40mol£¬Čē¹ū“ĖŹ±ŅĘ×ß1.0mol PCl3ŗĶ0.50mol Cl2£¬ŌŚĻąĶ¬ĪĀ¶ČĻĀŌŁ“ļĘ½ŗāŹ±PCl5µÄĪļÖŹµÄĮæŹĒ£Ø £©
A. 0.40mol B. 0.20mol
C. Š”ÓŚ0.20mol D. “óÓŚ0.20mol£¬Š”ÓŚ0.40mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij³§·ĻĖįÖ÷ŅŖŗ¬ĮņĖį”¢Fe3+”¢Fe2+”¢TiO2+”¢Al3+ ”£ĄūÓĆøĆ·ĻŅŗÖʱø¹ż¶žĮņĖįļ§[( NH4) 2S2O8]ŗĶTiO2µÄŅ»ÖÖ¹¤ŅÕĮ÷³ĢČēĻĀ:

ŅŃÖŖ£ŗi.TiOSO4ŌŚČČĖ®ÖŠŅ×Ė®½āÉś³ÉH2TiO3,Ļą¹ŲĄė×ÓŠĪ³ÉĒāŃõ»ÆĪļ³ĮµķµÄpH·¶Ī§Čē ĻĀ±ķ:
½šŹōĄė×Ó | TiO2+ | Fe3+ | Fe2+ | Al3+ |
æŖŹ¼³ĮµķµÄpH | 1.2 | 1.9 | 7.0 | 3.2 |
³ĮµķĶźČ«µÄpH | 2.8 | 3.1 | 9.4 | 4.7 |
ii. pH>7 Ź±,Fe2+²æ·ÖÉś³É Fe( ¢ņ)°±ĀēĄėFe(NH3)2]2+o
Ēė»Ų“šĻĀĮŠĪŹĢā:
(1)¼ÓČėŹŹĮæFeµÄ×÷ÓĆŹĒ________________ .
(2)Éś³ÉTiO(OH)2µÄ»Æѧ·½³ĢŹ½ĪŖ_______________ ”£
(3)ĀĖŌüI”¢ĀĖŌüII¾łŗ¬ÓŠµÄĪļÖŹµÄ»ÆѧŹ½ĪŖ_____________ .
(4)¼ÓČėH2O2µÄÄæµÄŹĒ³żµōFe( ¢ņ)°±ĀēĄė×Ó[Fe(NH3)2]2+,“Ė¹ż³ĢÖŠŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĄķĀŪÉĻµČÓŚ________ (ĢīŹżÖµ)”£
(5)³£ĪĀĻĀ£¬ŗ¬ĮņĪ¢Į£Ö÷ŅŖ“ęŌŚŠĪŹ½ÓėpHµÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£

ÓĆPtµē¼«µē½ā±„ŗĶNH4HSO4ČÜŅŗÖʱø¹ż¶žĮņĖįļ§Ź±£¬ĪŖĀś×ćŌŚŃō¼«·ÅµēµÄĄė×ÓÖ÷ŅŖĪŖ HSO4-£¬Ó¦µ÷½ŚŃō¼«ĒųČÜŅŗµÄpH·¶Ī§ŌŚ______Ö®¼ä,Ęäµē¼«·“Ó¦Ź½ĪŖ____________ ”£
(6)æĘŃŠČĖŌ±³£ÓĆĮņĖįĢśļ§[NH4Fe(SO4)2]µĪ¶Ø·Ø²ā¶ØTiO2µÄ“æ¶Č£¬Ęä²½ÖčĪŖ£ŗ ÓĆ×ćĮæĖįČܽāwg ¶žŃõ»ÆīŃѳʷ£¬ÓĆĀĮ·Ū×ö»¹Ō¼Į£¬¹żĀĖ”¢Ļ“µÓ£¬½«ĀĖŅŗ¶ØČŻĪŖ100 mL,Č” 25.00 mL,ŅŌNH4SCN×÷ÖøŹ¾¼Į£¬ÓƱź×¼ĮņĖįĢśļ§ČÜŅŗµĪ¶ØÖĮÖÕµć£¬·“Ó¦ŌĄķĪŖ: Ti3++Fe3+=Ti4++Fe2+”£
¢ŁÅŠ¶ĻµĪ¶ØÖÕµćµÄ·½·Ø£ŗ________________________ ”£
¢ŚµĪ¶ØÖÕµćŹ±ĻūŗÄc mol/L-1 NH4Fe(SO4)2ČÜŅŗVmL,ŌņTiO2“æ¶ČĪŖ___________(Š“ēĻą¹Ų×ÖÄø±ķŹ¾µÄ“śŹżŹ½)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗ2CH3OH(g)![]() CH3OCH3(g)£«H2O(g)””¦¤H£½£25 kJ/mol”£Ä³ĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżĪŖ400”£“ĖĪĀ¶ČĻĀ£¬ŌŚ1 LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČėCH3OH£¬·“Ó¦µ½Ä³Ź±æĢ²āµĆø÷×é·ÖµÄĪļÖŹµÄĮæÅضČČēĻĀ£ŗ
CH3OCH3(g)£«H2O(g)””¦¤H£½£25 kJ/mol”£Ä³ĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżĪŖ400”£“ĖĪĀ¶ČĻĀ£¬ŌŚ1 LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČėCH3OH£¬·“Ó¦µ½Ä³Ź±æĢ²āµĆø÷×é·ÖµÄĪļÖŹµÄĮæÅضČČēĻĀ£ŗ
ĪļÖŹ | CH3OH | CH3OCH3 | H2O |
c/(mol”¤L£1) | 0.8 | 1.24 | 1.24 |
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
¢ŁĘ½ŗāŗóÉżøßĪĀ¶Č£¬Ę½ŗā³£Źż>400
¢ŚĘ½ŗāŹ±£¬c(CH3OCH3)£½1.6 mol/L
¢ŪĘ½ŗāŹ±£¬·“Ó¦»ģŗĻĪļµÄ×ÜÄÜĮæ¼õŠ”20 kJ
¢ÜĘ½ŗāŹ±£¬ŌŁ¼ÓČėÓėĘšŹ¼µČĮæµÄCH3OH£¬“ļŠĀĘ½ŗāŗóCH3OH×Ŗ»ÆĀŹŌö“ó
¢Ż“ĖŹ±æĢ·“Ó¦“ļµ½Ę½ŗāדĢ¬
¢ŽĘ½ŗāŹ±CH3OHµÄÅضČĪŖ0.08 mol”¤L£1
A. ¢Ł¢Ś¢Ü¢Ż B. ¢Ś¢Ž C. ¢Ś¢Ū¢Ü¢Ž D. ¢Ś¢Ü¢Ž
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æPETŹĒŅ»ÖÖÖĘ×÷ŅūĮĻĘæµÄĖÜĮĻ”£ŅŌÓŠ»śĪļA(·Ö×ÓŹ½ĪŖC9H9O2Br)ŗĻ³ÉPET¼°FµÄ×Ŗ »Æ¹ŲĻµČēĻĀĶ¼”£ĘäÖŠDĪŖ¶ŌŅŅ»ł±½¼×Ėį,æÉÓĆ×÷Ņŗ¾§ŌĮĻ¼°ÖŠ¼äĢ唣A”¢C”¢D”¢E¾łÄÜNaHCO3ČÜŅŗ·“Ó¦”£

ŅŃÖŖ£ŗI.A·Ö×ÓµÄŗĖ“Ź²ÕńĒāĘ×ÉĻÓŠĪåøö·å,ĘäĆ껿֮±ČĪŖ1 £ŗ 2 £ŗ 2 £ŗ 2 £ŗ 2
II (R1”¢R2“ś±ķĢž»ł»ņĒāŌ×Ó)
(R1”¢R2“ś±ķĢž»ł»ņĒāŌ×Ó)
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1) »ÆŗĻĪļDµÄ·Ö×ÓŹ½ĪŖ_______£¬·“Ó¦¢ŁµÄ·“Ó¦ĄąŠĶŹĒ__________·“Ó¦”£
(2)øß·Ö×Ó»ÆŗĻĪļFµÄ½į¹¹¼ņŹ½ĪŖ_________.
(3) ·“Ó¦¢ŻµÄ»Æѧ·½³ĢŹ½ĪŖ______________________”£
(4)ĄūÓĆ·“Ó¦¢ŁŗóµÄČÜŅŗ£¬Éč¼ĘŹµŃéÖ¤Ć÷A·Ö×ÓÖŠŗ¬ÓŠµÄĀ±ĖŲŌ×ÓĪŖäåŌ×ӵďµŃé²½ÖčŗĶĻÖĻóĪŖ________________________
(5)Š“³ö·ūŗĻĻĀĮŠĢõ¼žDµÄĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½_______________________.
a.ÄÜ·¢ÉśŅų¾µ·“Ó¦ b.ÄÜÓėFeCl3.ČÜŅŗ·¢ÉśĻŌÉ«·“Ó¦ c.±½»·ÉĻµÄŅ»ĀČ“śĪļÖ»ÓŠŅ»ÖÖ
(6)Š“³öŅŌŅŅĻ©ĪŖĘšŹ¼ŌĮĻÖʱøĮłŌŖ»·õ„( )µÄŗĻ³ÉĀ·Ļß(ĘäĖūŹŌ¼ĮČĪŃ”)___________________
)µÄŗĻ³ÉĀ·Ļß(ĘäĖūŹŌ¼ĮČĪŃ”)___________________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
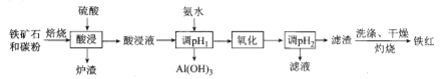
”¾ĢāÄæ”æøßĮ×öÜד³ąĢśæó(Ö÷ŅŖŗ¬ÓŠ![]() ”¢ÉŁĮæ
”¢ÉŁĮæ![]() ”¢CaO£¬
”¢CaO£¬![]() µČ)ŹĒĪŅ¹śŅ»ÖÖÖŲŅŖµÄ³Į»żŠĶĢśæó׏Ō“£¬ŅŌøßĮ×öÜד³ąĢśæóĪŖŌĮĻÖʱø“æ¶Č½ĻøßµÄĢśŗģ£¬ĘäĮ÷³ĢČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
µČ)ŹĒĪŅ¹śŅ»ÖÖÖŲŅŖµÄ³Į»żŠĶĢśæó׏Ō“£¬ŅŌøßĮ×öÜד³ąĢśæóĪŖŌĮĻÖʱø“æ¶Č½ĻøßµÄĢśŗģ£¬ĘäĮ÷³ĢČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
A. ĢśŗģæÉÓĆÓŚÓĶĘį”¢ÓĶÄ«”¢½ØÖžĪļ×ÅÉ«¼Į
B. Ėį½žŅŗÓö![]() ČÜŅŗÉś³ÉĄ¶É«³Įµķ
ČÜŅŗÉś³ÉĄ¶É«³Įµķ
C. Ļ“µÓĀĖŌüŹ±ŅŖÓĆ²£Į§°ō²»¶Ļ½Į°č
D. Ńõ»ÆŹ±Ń”ÓƵďŌ¼ĮæÉŅŌŹĒ![]() ”¢NaClOČÜŅŗ
”¢NaClOČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A. ±ź×¼×“æöĻĀ£¬22.4L¼ŗĶéÖŠŗ¬ÓŠ·Ö×ÓŹżÄæĪŖNA
B. 1mol/LNaOHČÜŅŗÖŠŗ¬ÓŠNa+ŹżÄæĪŖNA
C. 7.8gNa2O2ÖŠŗ¬ÓŠµÄ¹²¼Ū¼üŹżÄæĪŖ0.1NA
D. ½«0.5molN2O4³äČėĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ó¦×Ŗ»Æ³ÉNO2µÄŹżÄæĪŖNA
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com