
【题目】下列有关装置图的叙述中正确的是( )
A.装置 中桥墩应与电源的负极相连能被保护,该方法叫做外加电流的阴极保护法
中桥墩应与电源的负极相连能被保护,该方法叫做外加电流的阴极保护法
B.装置 的总反应式:Cu+2Fe3+=Cu2++2Fe2+
的总反应式:Cu+2Fe3+=Cu2++2Fe2+
C.装置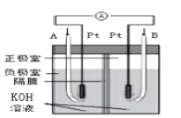 为氢氧燃料电池的工作原理,A中通入的气体是氧气
为氢氧燃料电池的工作原理,A中通入的气体是氧气
D.装置 为碱性锌锰干电池,其负极的电极反应式为:Zn-2e-=Zn2+
为碱性锌锰干电池,其负极的电极反应式为:Zn-2e-=Zn2+
科目:高中化学 来源: 题型:
【题目】在反应3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol H2O作为还原剂时,被还原的BrF3的物质的量为( )
A. 3 mol B. 2 mol C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺.以硫酸工业产生的二氧化硫尾气、氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质.合成路线如下:
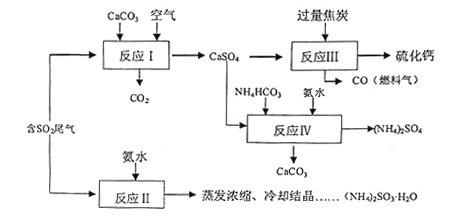
(1)写出反应Ⅰ的化学方程式________________________.
(2)反应Ⅲ中每生成lmol硫化钙理论上转移电子数________;为充分利用副产品CO,有人提出以熔融的K2C03为电解质,设计燃料电池,请写出此电池的负极反应_____________.
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有__________________.
(4)根据合成流程,可以循环利用的是____________.
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的离子方程式___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学反应的描述正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO的燃烧热ΔH=-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) ΔH=(2×283.0)kJ/mol
C.已知:C(s)+O2(g)=CO2(g)△H1;C(s)+![]() O2(g)=CO(g)△H2 ,则△H1>△H2
O2(g)=CO(g)△H2 ,则△H1>△H2
D.C(石墨,s)= C(金刚石,s) ΔH=+1.9kJ·mol-1 ,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯氧化铁可作现代电子工业材料。以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图。已知当溶液的pH大于6.5,Fe2+开始转化成Fe(OH)2。

(1)步骤Ⅰ中过滤所得滤渣的主要成分是____,工业上可以利用一种弱酸溶解该物质,该弱酸为____。
(2)步骤Ⅱ中加入铁粉的目的是____。
(3)写出步骤Ⅳ中反应的离子方程式____。
(4)在空气中煅烧FeCO3可制备高纯氧化铁,煅烧所需的主要仪器为____(写一种仪器名称),FeCO3在煅烧前应充分洗涤干净,写出实验室洗涤沉淀的方法____。
(5)写出煅烧FeCO3可制备高纯氧化铁反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质![]() 括号内为杂质
括号内为杂质![]() ,所用的除杂试剂和分离方法都正确的是( )
,所用的除杂试剂和分离方法都正确的是( )
序号 | 不纯物 | 除杂试剂 | 分离方法 |
A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
B | 溴乙烷(Br2) | NaOH溶液 | 蒸馏 |
C | 溴苯(液溴) | 乙醇 | 分液 |
D | 乙醇(水) | 新制生石灰 | 蒸馏 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题
(1)FeCl3溶液呈酸性原因是__________________(用离子方程式表示);若把FeCl3溶液蒸干,灼烧,最后得到固体产物是 ____________。
(2)将1L 0.2 mol·L-1HA溶液与1L 0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)> c(A-),则混合溶液中c(HA)+c(A-)_____0.1 mol·L-1(填“>”、“<”或“=”)。
(3)浓度均为0.1 mol/L的四种溶液①氯化铵溶液、②碳酸氢铵溶液、③氨水、④硫酸氢铵中,NH4+浓度由大到小的顺序为________________________。(填序号)
(4)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3 ,为了得到纯净的MgCl2·2H2O晶体,应加入________(填化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________mol·L-1。
②常温下,若将0.01 mol·L-1 MgCl2溶液与________ mol·L-1 NaOH溶液等体积混合时有沉淀生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A | H2O | sp | 直线形 | 直线形 |
B | BBr3 | sp2 | 平面三角形 | 三角锥形 |
C | PCl3 | sp2 | 四面体形 | 平面三角形 |
D | CO32- | sp2 | 平面三角形 | 平面三角形 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH![]() 、SO
、SO![]() 、CO
、CO![]() 、K+ B. Na+、Ba2+、Ca2+、HCO
、K+ B. Na+、Ba2+、Ca2+、HCO![]()
C. Mg2+、SO![]() 、K+、Cl- D. K+、Cl-、Na+、SO
、K+、Cl- D. K+、Cl-、Na+、SO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com