
| A.4, 3, 1, 2 | B.3, 3, 2, 2 | C.4, 2, 2, 2 | D.2, 3, 3, 2 |
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:不详 题型:填空题
| A.制汽轮机叶片 | B.制有色玻璃 |
| C.制永久性模具 | D.制造柴油机 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
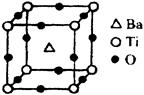
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu、Si和Ne三种晶体中,熔点最低的是Ne |
| B.晶体Mg属于金属晶体,其中Mg原子的堆积方式是面心立方最密堆积 |
| C.1mol晶体Si中,含有4molSi—Si键 |
| D.Si和Ne都是非金属元素,所以它们的晶体类型是相同的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.晶体在三维空间里呈周期性有序排列,因此在各个不同的方向上具有相同的物理性质 |
| B.晶体在熔化过程中需要不断的吸热,温度不断地升高 |
| C.普通玻璃在各个不同的方向上力学、热学、电学、光学性质相同 |
| D.晶体和非晶体之间不可以相互转化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
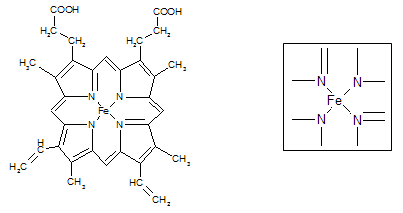
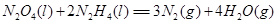
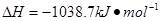
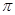 键有___________mol。
键有___________mol。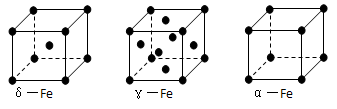
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.二氧化硅 | B.乙烷晶体 | C.碳酸钠 | D.氯化钠 E.晶体氩F.过氧化氢 G.镁(用字母填空) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
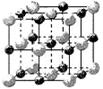
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com