
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液 | 若溶液不变红,则假设一成立,若溶液变红,则假设一不成立 |

分析 (1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量;
(2)草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体可能为氧化亚铁或四氧化三铁,分析判断;
(3)【定性研究】氧化亚铁溶解于盐酸生成氯化亚铁溶液,加入KSCN溶液,若溶液不变红证明假设一正确;
【定量研究】根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立不合理,氧化亚铁可以被空气氧化.
解答 解:(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量,依据氧化还原反应电子守恒原子守恒配平书写离子方程式为5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++3Mn2++5CO2↑+12H2O,消耗1.5mol FeC2O4•2H2O,则参加反应的KMnO4为0.9mol,
故答案为:还原性;0.9;
(2)假设一:全部是氧化亚铁;假设二:全部是四氧化三铁;假设三:氧化亚铁和四氧化三铁的混合物,
故答案为:全部是四氧化三铁;氧化亚铁和四氧化三铁的混合物;
(3)【定性研究】实验步聚:取少量黑色固体,加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液.现象与结论:若溶液不变红,则假设一成立,若溶液变红,则假设一不成立;
故答案为:加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液;若溶液不变红,则假设一成立,若溶液变红,则假设一不成立;
【定量研究】通过剩余固体的质量可知,过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,设失去结晶水x,图象分析可知固体质量变化1.0-0.8=0.2g,依据则反应的化学方程式计算为:
FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4•(2-x)H2O+xH2O△m
180 18x
1.0 0.2 x=2
加热到300°C,晶体全部失去结晶水生成草酸亚铁和水,
继续加热到400°C,固体质量减少0.8g-0.4g=0.4g;此时草酸亚铁分解减少的是气体质量,反应过程中一定存在反应生成氧化亚铁和二氧化碳,铁元素化合价不变时,依据元素化合价变化和电子守恒可知碳元素化合价从+3价变化为+4价,一定有化合价降低生成+2价的一氧化碳,反应的化学方程式FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO+CO2,
FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO+CO2 △m
144 72
0.8 0.4
计算结果符合图象固体质量变化,所以反应的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O或FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑,
故答案为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O或FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,依据铁元素守恒计算得到若生成氧化亚铁,质量为0.4g,但实验过程中最终残留黑色固体的质量大于0.4g,可能是实验未在密闭容器中进行,氧化亚铁被空气氧化为氧化铁,某同学由此得出结论:假设一不成立不合理,
故答案为:不同意,实验未在密闭容器中进行,FeO会被空气进一步氧化,生成铁的其它氧化物.
点评 本题考查了铁及其化合物性质的实验验证和实验分析判断,定量计算,图象分析是解题关键,题目难度较大.


科目:高中化学 来源: 题型:解答题
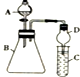 某同学利用如图装置探究同主族元素非金属性的变化规律.
某同学利用如图装置探究同主族元素非金属性的变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质、乙酸都能发生水解反应 | |
| B. | 糖类、油脂、蛋白质都是只由C、H、0三种元素组成的 | |
| C. | 糖类、油脂、蛋白质都是天然高分子化合物 | |
| D. | 油脂有油和脂肪之分,但都属于酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
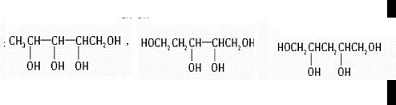
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
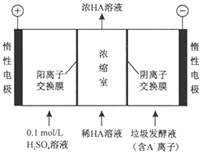 对生活污水进行处理是防止水体污染、改善水质的主要措施.电渗析法处理厨房垃圾发酵液(含污染物乳酸跟离子)同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).下列叙述中正确的是( )
对生活污水进行处理是防止水体污染、改善水质的主要措施.电渗析法处理厨房垃圾发酵液(含污染物乳酸跟离子)同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).下列叙述中正确的是( )| A. | 阴极区溶液的pH变小 | |
| B. | 阳极的电极反应式为2H2O-4e-═4H++O2↑ | |
| C. | 通过一段时间后浓缩至水的量减少,导致乳酸溶液浓度上升 | |
| D. | 若阳、阴离子交换膜调换位置,与如图可以达到相同的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
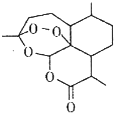 屠呦呦团队发现并提取了青蒿素(结构如图),开创疟疾治疗新方法;屠呦呦因此荣获2015年诺贝尔生理学或医学奖.下列有关青蒿素的叙述错误的是( )
屠呦呦团队发现并提取了青蒿素(结构如图),开创疟疾治疗新方法;屠呦呦因此荣获2015年诺贝尔生理学或医学奖.下列有关青蒿素的叙述错误的是( )| A. | 分子式为C15H22O5 | B. | 属于芳香族化合物 | ||
| C. | 能与Cl2发生取代反应 | D. | 能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
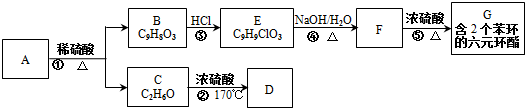
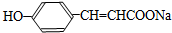 .
.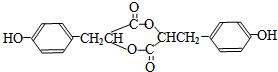 .
.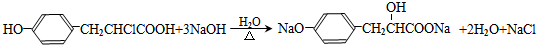 :反应①:
:反应①: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2转化为燃料可减少CO2温室气体的排放 | |
| B. | CO2转化为HCOOH过程是CO2被还原的过程 | |
| C. | 新型电催化材料降低了CO2催化还原的活化能 | |
| D. | 新型电催化材料提高了CO2还原为HCOOH的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 元素的相关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 原子的M电子层上有3个电子 |
| C | 在短周期主族元素中,其原子半径最大 |
| D | 其最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反 应生成D的单质和H2O |
| E | 元素最高正价与最低负价的代数和为6 |
| A. | A的气态氢化物具有还原性,常温下,该氢化物水溶液的pH>7 | |
| B. | C单质在氧气中燃烧后的产物中阴阳离子个数之比为1:2 | |
| C. | 在B和E所形成的化合物中存在离子键 | |
| D. | C与D可形成不同原子或离子个数比的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com